微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 某化学研究性学习小组探讨Fe3+和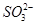 之间发生怎样的反应,请你一起参与并协助他们完成实验。(1)提出猜想:
之间发生怎样的反应,请你一起参与并协助他们完成实验。(1)提出猜想:
甲同学认为发生氧化还原反应,其反应方程式为____________________________________。
乙同学认为发生双水解反应,其反应方程式为2Fe3++3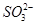 +6H2O===2Fe(OH)3(胶体)+3H2SO3。
+6H2O===2Fe(OH)3(胶体)+3H2SO3。
……
(2)实验验证:
丙同学设计了下列实验来探究反应的可能性。
①为了检验所用Na2SO3是否变质,应选用的试剂是___?_____。
②取5 mL FeCl3溶液于试管中,逐滴加入Na2SO3溶液至过量,观察到溶液颜色由黄色变为红棕色(无气泡产生,也无沉淀生成)。
③将②溶液分成两等份,其中一份加入稀盐酸至过量,再加入BaCl2稀溶液,有白色沉淀生成;另一份滴入几滴KSCN溶液,溶液变成血红色。
(3)得出结论:
①根据丙同学的实验得出的结论是:________________?____________。
②实验③中溶液变成血红色的有关离子方程式为_________?____。
(4)拓展探究:
①丁同学在FeCl3溶液中加入Na2CO3溶液,观察到红褐色沉淀并且产生无色气体,该反应的离子方程式是________?__________________。
②从形式上看,Na2CO3和Na2SO3相似,但是从上述实验中可以看到,两者的水溶液与氯化铁溶液反应的现象差别很大,其可能的原因除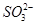 水解能力较
水解能力较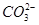 小外,还有_?_______。
小外,还有_?_______。
参考答案:(12分)(1)2Fe3++SO32-+H2O===2Fe2++SO42-+2H+?(2)①BaCl2溶液、稀盐酸
(3)①Fe3+与SO32-同时发生氧化还原反应和双水解反应
②Fe(OH)3(胶体)+3SCN-===Fe(SCN)3+3OH-
(4)①2Fe3++3CO32-+3H2O===2Fe(OH)3↓+3CO2↑
②SO32-有较强的还原性,而CO32-还原性很弱
本题解析:(1)如果发生氧化还原反应,则应该是铁离子氧化SO32-,所以反应的离子方程式是2Fe3++SO32-+H2O===2Fe2++SO42-+2H+。
(2)亚硫酸钠易被氧化生成生成硫酸钠,所以为了检验所用Na2SO3是否变质,应选用的试剂是氯化钡溶液和稀盐酸。
(3)①根据丙中的实验现象可知,反应中有氢氧化铁胶体和硫酸钠生成,这说明Fe3+与SO32-同时发生氧化还原反应和双水解反应。
②③中溶液变成血红色是铁离子的检验,所以有关离子方程式为Fe(OH)3(胶体)+3SCN-===Fe(SCN)3+3OH-。
(4)①观察到红褐色沉淀并且产生无色气体,这说明反应中有氢氧化铁沉淀和CO2气体生成,所以反应的离子方程式是2Fe3++3CO32-+3H2O===2Fe(OH)3↓+3CO2↑。
②根据实验现象可推测,除SO32-水解能力较CO32-小外,还有就是由于SO32-有较强的还原性,而CO32-还原性很弱。
点评:该题是高考中的常见题型,难度较大,试题综合性强,学生不易得分。该试题通过探讨Fe3+和SO32-之间的反应考查学生对氧化还原反应和盐类的水解反应掌握的基本程度,该试题还通过鼓励学生去大胆的猜想及拓展探究实验,考查学生的基本科学素养。该类试题综合性强,理论和实践的联系紧密,有的还提供一些新的信息,这就要求学生必须认真、细致的审题,联系所学过的知识和技能,进行知识的类比、迁移、重组,全面细致的思考才能得出正确的结论。
本题难度:一般
2、选择题 可溶性化合物A、B、C由下表中离子组合而成(每种离子只存在于一种化合物中)。
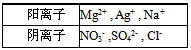
现将等物质的量的A、B、C一起溶于水后,所得混合溶液中除H+、OH-外还含有五种离子。则A的化学式不可能是
[? ]
A. AgNO3
B. Na2SO4
C. MgCl2
D. MgSO4
参考答案:D
本题解析:
本题难度:简单
3、实验题 甲、乙、丙三位同学各设计了一个实验,结果各自都认为自己的试样中含有SO42-离子。
甲的实验为:

(1)乙认为甲的实验不严谨,因为试样A中若含有?离子(仅填一种)也会有此现象。
乙的实验为:

(2)丙认为乙的实验也不严谨,因为试样B中若含有?离子(仅填一种)也会有此现象。
丙的实验为:

若丙方案合理,回答:
(3)若丙实验合理,则其中试剂Ⅰ是?,现象Ⅰ是?;试剂Ⅱ是?,现象Ⅱ是?。(若你认为丙方案不合理,以上四空可以不填)
参考答案:(1)Ag+(2)SO32-(3)盐酸,无沉淀和气体生成,BaCl2,白色沉淀
本题解析:检验SO42-常会受到Ag+、CO32-、SO32-的干扰,因为当向待测溶液中滴加氯化钡溶液,如果待测溶液中存在Ag+,同样会产生一种不溶于酸的白色沉淀氯化银。因此,在检验SO42-的过程中,为了排除Ag+的干扰,常先往溶液中滴加适量稀盐酸后再滴加氯化钡溶液。同时亚硫酸根离子容易被硝酸氧化为硫酸根离子干扰检验,所以常选用稀盐酸不选用硝酸。
点评:检验SO42-常选用试剂氯化钡溶液和稀盐酸,先加稀盐酸,后加氯化钡溶液,观察是否产生不溶于酸的白色沉淀硫酸钡。属于中等题。
本题难度:一般
4、选择题 对溶液中的离子进行鉴定,下列实验所得结论不合理的是
A.加入稀硝酸后,再加入AgNO3溶液,有白色沉淀生成,则说明原溶液中含有Cl-
B.加入KSCN溶液无红色出现,再加入氯水溶液变血红色,说明原溶液中一定含有Fe2+
C.加入用稀硝酸酸化的Ba(NO3)2溶液产生白色沉淀,则可推断原溶液中一定含有SO42-
D.加入盐酸产生使澄清石灰水变浑浊的无色无味的气体,可推测原溶液中含有CO32-离子或HCO3-
参考答案:C
本题解析:解:A.向溶液中加入稀硝酸后,再加入AgNO3溶液有白色沉淀生成,发生反应为Cl-+Ag+═AgCl↓,AgCl不溶于稀硝酸,可确定溶液中含有Cl-,故A合理;
B.KSCN溶液是用于检验Fe3+的试剂,向溶液中加入KSCN溶液,观察无明显现象,说明溶液中不含Fe3+.继续加入氯水,溶液变红色,说明溶液存在Fe3+,而只能是溶液中Fe2+的和加入的氯水反应生成,2Fe2++Cl2═2Fe3++2Cl-.所以溶液中一定含有Fe2+,故B合理;
C.加HNO3酸化后,再加过量的AgNO3,溶液中析出白色沉淀,证明含有氯离子,故C不合理;
D.根据题意,使澄清石灰水变浑浊的无色无味气体为CO2.而溶液中与盐酸反应产生CO2的离子有CO32-、HCO3-,反应为CO32-+2H+═CO2↑+H2O、HCO3-+H+═CO2↑+H2O.所以溶液中可能含有CO32-或HCO3-或两者都有,故D合理;
故选C.
本题难度:简单
5、填空题 对一瓶无色、澄清的稀溶液作初步分析后发现,其中可能含有SO42-、Na+、CO32-、H+、NO3-、HCO3-、Cl-等离子中的若干种。进一步的分析结果如下:
(1)用pH试纸测定溶液的pH,试纸呈红色(酸性色)
(2)取2mL溶液滴加少量BaCl2溶液,有白色沉淀生成,再滴加少量稀HNO3,沉淀不消失
(3)对(2)中所得的混合物,充分静置后,取上层清液滴加少量AgNO3溶液,又有白色沉淀生成,再滴加少量稀HNO3,沉淀不消失
则:(1)溶液中一定存在的离子是?,一定不存在的离子是?。
(2)能否判断原溶液中是否含有Cl-??(“是” 或“否” ),其原因为?;若要确定溶液中是否含有Cl-,其正确的操作是?。
参考答案:(1)H+、SO42-;CO32-、HCO3-;
(2)否;因第(2)步实验中带入了Cl-;将第(2)步中的少量BaCl2改为足量的Ba(NO3)2溶液即可。
本题解析:(1)用pH试纸测定溶液的pH,试纸呈红色说明含有(酸性色)H+,与H+不能共存的CO32-、HCO3-一定不存在;(2)取2mL溶液滴加少量BaCl2溶液,有白色沉淀生成,再滴加少量稀HNO3,沉淀不消失,该沉淀可能为氯化银,也可能为硫酸钡,所以不能判断是否有Cl-存在;若要确定溶液中是否含有Cl-,其正确的操作是将第(2)步中的少量BaCl2改为足量的Ba(NO3)2溶液即可。
本题难度:一般