|
高中化学必备知识点《离子方程式的书写及正误判断》考点特训(2017年冲刺版)(二)
2017-09-24 00:53:28
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列离子方程式书写正确的是
A.将Na加入到CuSO4溶液中: 2Na+Cu2+=Cu+2Na+
B.向Ba(OH)2溶液中通入过量CO2:CO2 + OH-= HCO3-
C.向NaHSO4溶液加入Ba(OH)2溶液至中性:H++ SO42-+Ba2++OH-=BaSO4↓+ H2O
D.向氯化铝溶液中加入足量氨水: Al3++ 4NH3·H2O = AlO2-+ 2H2O +4NH4+
|
参考答案:B
本题解析:金属钠加入到CuSO4溶液中:2Na+2H2O+ Cu2+
本题难度:一般
2、填空题 (14分)NaHSO3可被过量KIO3氧化,当NaHSO3完全消耗时即有I2析出。某课题组用淀粉作指示剂,通过测定溶液变蓝所用时间来探究影响化学反应速率的因素。
(1)写出NaHSO3溶液与过量KIO3溶液反应生成I2的离子方程式: 。
(2)调节反应物浓度和温度进行对比实验,记录结果如下:
编号
| 0.02mol/LNaHSO3溶液/mL
| 0.02mol/LKIO3溶液/mL
| H2O/mL
| 反应温度/℃
| 溶液变蓝的时间t/s
| ①
| 10
| 15
| a
| 10
| t1
| ②
| 10
| 40
| 0
| 10
| t2
| ③
| 10
| b
| 0
| 20
| t3
|
表中a= ,b= 。
(3)改变反应温度,重复实验③,得到温度(T)与溶液变蓝所需时间(t)的关系如下图所示(“×××”表示超过50℃后溶液不会再变蓝)。
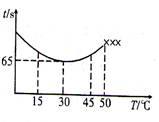
①在30℃下,若溶液变蓝时,I2的物质的量为n mol,则从反应开始至溶液变蓝,IO3-的平均反应
速率 mol·L-1·s-1(写出表达式即可,不要化简)。
②根据图像,请你分析温度低于50℃时,溶液变蓝所需时间与反应温度的关系: 。
(4)将NaHSO3溶液与KIO3溶液混合(预先加入可溶性淀粉为指示剂),用速率检测仪检测出起始阶段反应速率逐渐增大,一段时间后反应速率又逐渐减小。课题组对起始阶段反应速率逐渐增大的原因提出如下假设,请你完成假设二:
假设一:反应生成的I2对反应起催化作用;
假设二: ;
………………
(5)请你设计实验验证上述假设一,完成下表中内容(反应速率可用测速仪测定)。
实验方案(不要求写出具体操作过程)
| 预期实验现象和结论
|
|
|
参考答案:(14分)
(1)2IO3?+5HSO3?=5SO42?+I2+3H++H2O (2分) (2)25 (1分) 40 (1分)
(3)① 2n/(50×10-3×65)
②温度低于30℃时,温度越高,溶液变蓝所需时间越短;温度高于30℃时,温度越高,溶液变蓝所需时间越长(2分,本小题具有开放性,答案合理都得分)
(4)反应生成的H+对反应起催化作用,H+浓度越大反应速率越快;或反应生成的SO42?对反应起催化作用,SO42?浓度越大反应速率越快;或该反应是放热反应,温度升高导致反应速率加快(2分,本小题具有开放性,答案合理都得分)
(5)
实验方案(不要求写出具体操作过程)
预期实验现象和结论
在烧杯甲中将NaHSO3溶液与过量KIO3溶液混合,用测速仪测定起始时的反应速率v(甲);在烧杯乙中进行同一反应(不同的是乙烧杯中预先加入少量I2,其它反应条件均完全相同),测定其起始阶段的相同时间内的反应速率v(乙)
若v(甲)= v(乙),则假设一不成立;若v(甲)< v(乙),则假设一成立。
本题解析:(1)NaHSO3溶液与过量KIO3溶液反应生成I2,根据氧化还原反应原理和元素守恒,IO3?与HSO3?反应生成SO42?、I2、H+和H2O,则离子方程式为:2IO3?+5HSO3?=5SO42?+I2+3H++H2O。
(2)为了使这3组实验具有可比性,溶液的体积应相等,所以a=25mL;b=40mL。
(3)①根据图像,从反应开始至溶液变蓝需要的时间为65s,溶液变蓝时,I2的物质的量为n mol,则消耗IO3-物质的量为2n mol,根据表中数据溶液的体积为65mL,则v(IO3?)=2n/(50×10-3×65)mol·L-1·s-1。
②根据图像可以看出,30℃时溶液变蓝所需时间最少,温度低于30℃时,温度越高,溶液变蓝所需时间越短;温度高于30℃时,温度越高,溶液变蓝所需时间越长。
(4)该反应除了生成I2,还生成了SO42?和H+,则假设二起催化作用的可能为H+或SO42?,也可以从温度升高等方面提出假设。
(5)假设一为反应生成的I2对反应起催化作用;所以验证实验为对比实验,一个烧杯将NaHSO3溶液与过量KIO3溶液混合,用测速仪测定起始时的反应速率v(甲);另一烧杯预先加入少量I2,其它反应条件均完全相同,通过对比二者反应速率进行检验。
考点:本题考查实验方案的设计与评价、离子方程式的书写、反应速率的计算及影响因素。
本题难度:困难
3、填空题 (8分)(1)写出下列反应的离子方程式:
①Ba(OH)2 和CuSO4 ____________________________________.
②CuO和H2SO4 _____________________________________.
(2)写出一个能实现下列离子反应的化学方程式:
①Fe+Cu2+=Fe2++Cu _______________________________________.
②CO32
参考答案:
本题解析:
本题难度:一般
4、填空题 随着大气污染的日趋严重,国家拟于“十二”五期间,将二氧化硫(SO2)排放量减少8%,氮氧化物(NOx)排放量减少10%。目前,消除大气污染有多种方法。
(1)用CH4催化还原氮氧化物可以消除氮氧化物的污染。已知:
①CH4(g)+4NO2(g) ="4NO(g)" + CO2(g) +2H2O(g)
参考答案:
本题解析:
本题难度:困难
5、选择题 下列涉及离子方程式书写的评价合理的是 ( )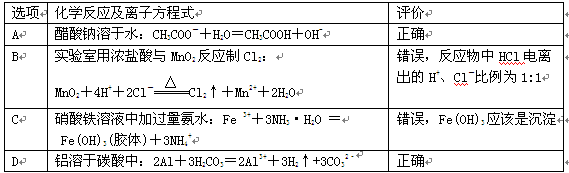
参考答案:C
本题解析:A项:水解反应是可逆反应,符号应为“ ”;B项:离子方程式是正确的,多余的2个Cl-在溶液中没参加化学反应;D项:铝与碳酸会有所反应,反映分为两步。碳酸是CO2的水溶液,里面有H+、OH-、CO32-、HCO3-、H2O、H2CO3、CO2这几种离子和物质,当AL投入的时候,会与水发生反应,产生Al(OH)3,如果只是纯粹水溶液的话由于反映产生的Al(OH)3是一层质密的薄膜,将Al与水阻挡开,使反应停止。但是水溶液里面还有大量酸性的H+、HCO3-离子,会与Al(OH)3反映,使反应继续下去,最终反应能够得到Al3+离子的,其实反映的实质就是Al+6H2O —— 2Al(OH)3+3H2,而中间借助了酸溶液的酸性,使反应不断进行,最后得到Al3+,但是水解又会得到Al(OH)3,Al3++3H2O=Al(OH)3+3H+,而酸是弱酸,双水解情况下,不存在Al2(CO3)3,所以最后就是得到Al(OH)3,而不是单质Al,,反映的现象是冒气泡和生成沉淀,总之:碳酸铝是不存在的,或者说是极其不稳定,只有在少数高端实验室条件下才可以实现。而单质铝投入碳酸水中是会反应的,实验现象是生成沉淀和冒气泡,沉淀是氢氧化铝。故选C。 ”;B项:离子方程式是正确的,多余的2个Cl-在溶液中没参加化学反应;D项:铝与碳酸会有所反应,反映分为两步。碳酸是CO2的水溶液,里面有H+、OH-、CO32-、HCO3-、H2O、H2CO3、CO2这几种离子和物质,当AL投入的时候,会与水发生反应,产生Al(OH)3,如果只是纯粹水溶液的话由于反映产生的Al(OH)3是一层质密的薄膜,将Al与水阻挡开,使反应停止。但是水溶液里面还有大量酸性的H+、HCO3-离子,会与Al(OH)3反映,使反应继续下去,最终反应能够得到Al3+离子的,其实反映的实质就是Al+6H2O —— 2Al(OH)3+3H2,而中间借助了酸溶液的酸性,使反应不断进行,最后得到Al3+,但是水解又会得到Al(OH)3,Al3++3H2O=Al(OH)3+3H+,而酸是弱酸,双水解情况下,不存在Al2(CO3)3,所以最后就是得到Al(OH)3,而不是单质Al,,反映的现象是冒气泡和生成沉淀,总之:碳酸铝是不存在的,或者说是极其不稳定,只有在少数高端实验室条件下才可以实现。而单质铝投入碳酸水中是会反应的,实验现象是生成沉淀和冒气泡,沉淀是氢氧化铝。故选C。
考点:离子方程式正误判断
点评:离子方程式正误判断要注意:看原则:看是否符合客观事实、看是否符合质量守恒、看是否符合电荷守恒、看是否符合得失电子相等、看连接符号是否正确、注意双水解的离子不能共存。可溶的易电离的物质拆成离子。注意过量、少量、适量等。
本题难度:一般
| 