| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高中化学必备知识点《离子方程式的书写及正误判断》考点特训(2017年冲刺版)(四)
参考答案:C 本题解析:H++OH-=H2O 可表示可溶性强酸与可溶性强碱的中和反应,A、氢氧化镁不溶于水,A错误;B、Ba(OH)2溶液滴入稀硫酸中,除生成水外还生成硫酸钡沉淀,B错误;C、澄清石灰水和稀硝酸反应,C正确;D、二氧化碳通入澄清石灰水中,二氧化碳是氧化物,与水反应生成碳酸,碳酸是弱酸,D错误;答案选C。 本题难度:一般 2、选择题 能正确表示下列反应的离子方程式的是 |
参考答案:C
本题解析:A项离子方程式电荷不守恒,故A项错误;B项碳酸钙为难溶物,应写化学式不能拆,故B项错误;D项离子方程式前后电荷不守恒,故D项错误;C项正确。
考点:离子方程式书写判断正误。
本题难度:一般
3、填空题 现有含淀粉、NaCl、Na2SO4、CaCl2的混合溶液,选择适当的试剂和方法从中提纯出NaCl晶体。相应的实验过程如下: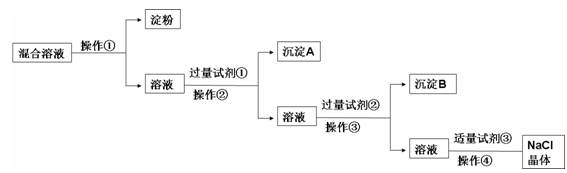
(1)a.操作①是利用胶体中胶体粒子______________(填“能”或“不能”)透过半透膜,溶液溶质分子、离子__________(填“能”或“不能”)透过半透膜进行分离提纯。
b.如何用实验证明淀粉未透过半透膜而Cl-已透过半透膜:
______________________________________________________
_____________ ______
(2)写出上述实验过程中所用试剂:
试剂①_______________________;试剂③________________________。
(3)判断试剂①已过量的方法是:________________________________________。
(4)用化学方程式表示加入试剂②的作用:
________________________________________________________ ____________
(5)操作④的名称是__________________________。
参考答案:(1)a.不能; 能;
b.用两支试管分别取半透膜外的溶液,往其中一支试管滴加AgNO3溶液,产生白色沉淀,说明Cl-已透过半透膜;往另一支试管滴加碘水,溶液不变蓝,说明淀粉未透过半透膜。
(2)氯化钡溶液;稀盐酸
(3)静置,向上层清液中滴加少量氯化钡溶液,没有白色沉淀产生,说明氯化钡溶液已过量。
(4)BaCl2+Na2CO3=2NaCl+BaCO3↓ CaCl2+Na2CO3=2NaCl+CaCO3↓
(5)蒸发(结晶)
本题解析:略
本题难度:一般
4、选择题 下列各组的两种物质在溶液中的反应,可用同一离子方程式表示的是
A.氢氧化钠与盐酸;氢氧化钾与醋酸
B.Na2CO3溶液与KHSO4溶液;K2CO3溶液与HCl溶液
C.MgCl2溶液与NaOH溶液;Ba(OH)2溶液与MgSO4溶液
D.氧化钠与盐酸混合;氧化铜与稀盐酸
参考答案:B
本题解析:盐酸是强酸能完全电离,醋酸是弱酸不能完全电离,故A错误;KHSO4溶液能完全电离出氢离子,故反应本质均为氢离子与碳酸根离子的反应,B正确;MgCl2溶液与NaOH溶液生成氢氧化镁沉淀;Ba(OH)2溶液与MgSO4溶液 不但生成氢氧化镁沉淀还生成硫酸钡沉淀,C错误;氧化钠和氧化铜均为氧化物,只能写作化学式的形式,不能用同一离子反应表示,故D错误,答案选B。
考点:离子方程式书写
本题难度:一般
5、填空题 写出下列物质间反应的离子反应方程式:
(1)硫酸氢钠和氢氧化钠溶液 ;
(2)醋酸和氨水
(3)硝酸银溶液与氯化钾溶液 。
参考答案:A H++ OH-=H2O
CH3COOH + NH3·H2O = CH3COO- + NH4+ + H2O
Ag+ + Cl- =AgCl↓
本题解析:略
本题难度:简单
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高考化学知识点总结《原子的结构.. | |