微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 某实验小组以H2O2分解为例,研究浓度、催化剂、温度对反应速率的影响.按照如下方案完成实验.下列说法不正确的是
( )
| 反应物
催化剂 | 温度
①
10mL10%?H2O2溶液
无
25℃
②
10mL20%?H2O2溶液
无
25℃
③
10mL20%?H2O2溶液
无
40℃
④
10mL20%?H2O2溶液
1mL0.1mol?L-1FeCl3溶液
40℃
|
A.实验④反应速率最快
B.实验①反应速率最慢
C.实验②速率小于实验④的原因不仅仅是实验④加入了催化剂
D.FeCl3不但可以催化H2O2分解,也能催化Zn与盐酸反应制H2
参考答案:A、由表中数据可知,实验④中浓度最高、温度最高且使用催化剂,故反应速率最快,故A正确;
B、由表中数据可知,实验①中浓度最低、温度最低且没有使用催化剂,故反应速率最慢,故B正确;
C、由表中数据可知,实验②、④的不同之处是④中使用催化剂、温度比实验②中高,故实验②速率小于实验④的原因有催化剂、温度的影响,故C正确;
D、催化剂具有专一性,FeCl3可以催化H2O2分解,但不一定是其它反应的催化剂,FeCl3与Zn与发生反应,不能催化Zn与盐酸反应,故D错误.
故选D.
本题解析:
本题难度:简单
2、选择题 甲:在试管中加入1 g粉末状大理石,加入4 mol/L盐酸20 mL(过量);
乙:在试管中加入2 g颗粒状大理石,加入4 mol/L盐酸20 mL(过量);
生成体积(折算成标准状况)V(CO2)同反应时间t的关系曲线图合理的是(?)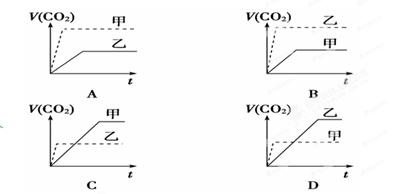
参考答案:D
本题解析:碳酸钙的表面积越大,和盐酸反应的反应速率就越大,据此可知甲中反应速率快,但生成的CO2体积小于乙中,所以答案选D。
点评:该题是高考中的常见题型,属于基础性试题的考查,试题基础性强,侧重对学生基础知识对巩固和训练,难度不大。该题的关键是熟练记住外界条件对反应速率的影响,并能结合题意灵活运用、分析、判断即可。
本题难度:简单
3、填空题 分析下列实例,根据已有的知识和经验,填写下表.
| 实例 | 影响速率的因素
夏天食物易变质
______
硫在氧气中比在空气中燃烧快
______
粉状的碳酸钙与盐酸反应比块状的碳酸钙反应快
______
氯酸钾与二氧化锰混合共热可快速产生氧气
______
工业合成氨通常要在高压下进行
______
参考答案:无论反应是放热反应还是吸热反应,只要升高温度,化学反应速率一定加快,夏天温度较高,加快了化学反应速率,所以夏天食物易变质;
增大反应物的浓度,能加快反应速率,氧气的浓度大于空气中氧气的浓度,所以硫在氧气中燃烧比在空气中燃烧快;
增大反应物的接触面积,能加快反应速率,粉末状的碳酸钙比块状的碳酸钙与盐酸的接触面积大,所以反应速率快;
二氧化锰在氯化钾的分解反应中作催化剂,催化剂能降低反应需要的活化能,所以能加快反应速率;
增大压强,气体的浓度增大,反应速率加快,所以合成氨需要在高压下进行;
故答案为:温度;浓度;接触面积大小;催化剂;压强.
本题解析:
本题难度:一般
4、填空题 在763 K和3.04×104kPa时,用CO与H2合成CH3OH:CO(g)+2H2(g) CH3OH(g)。 CH3OH(g)。
(1)设起始时,n(H2)∶n(CO)=m,平衡时CO转化率为α,CH3OH的体积分数为y,则m、α、y三者的关系是___________。
(2)将下表已知数据代入上述关系,进行计算,将结果填入表中:
?(3)根据表中数据,可得出最佳反应物的配比m是_________,原因是______________。
参考答案:(1)y=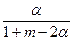 ×100% ×100%
(2)16.67%? 21.43%? 0.56
(3)2当m=2时,平衡气体中CH3OH的体积分数最大
本题解析:(1)设开始时CO为1 mol,则H2为m mol,
由:? CO+?2H2 ?CH3OH ?CH3OH
n始/mol:1?m?0
n变/mol:α?2α?α
n平/mol:1-αm-2α?α
平衡时n(总)=(1+m-2α)mol,
故y=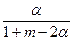 ×100%。 ×100%。
(2)直接代入(1)式进行计算得:16.67%、21.43%、0.56。
(3)由(2)知当m=2时,为最佳配比。
本题难度:简单
5、选择题 2A(g)+B(g)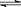 3C(g)+4D(g)的反应,不同条件下的反应的速率最快的是 3C(g)+4D(g)的反应,不同条件下的反应的速率最快的是
A.ν (A)=0.7mol·L-1·min-1?B.ν(B)=0.3 mol·L-1·min-1
C.ν(C)=0.9 mol·L-1·min-1? D.ν(D)=1.0mol·L-1·min-1
参考答案:A
本题解析:略
本题难度:简单
|