微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 能说明CH4分子的5个原子不在同一平面而为正四面体构型的是
[? ]
A.两个键之间夹角为109°28′?
B.C-H键为极性共价键
C.4个C-H键的键能、键长相同?
D.碳的价层电子都形成共价键
参考答案:A
本题解析:
本题难度:一般
2、选择题 电子表、电子计算器、电脑显示器都运用了液晶材料显示图像和文字。有关其显示原理的叙述中,正确的是?(?)。
A.施加电场时,液晶分子沿垂直于电场方向排列
B.移去电场后,液晶分子恢复到原来状态
C.施加电场后,液晶分子恢复到原来状态
D.移去电场后,液晶分子沿电场方向排列
参考答案:B
本题解析:液晶的显示原理为:施加电场时,液晶分子沿电场方向排列;移去电场后,液晶分子恢复到原来状态。
本题难度:一般
3、填空题 (1)下图为CO2分子晶体结构的一部分。观察图形,试说明每个CO2分子周围有?个与之紧邻等距的CO2分子。
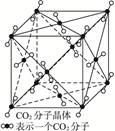 ?
?
(2)试判断:①CO2、②CS2、③SiO2晶体的沸点由高到低排列的顺序是?>?>?(填写相应物质的编号)。
参考答案:(1)12
(2)③ ② ①
本题解析:SiO2是原子晶体,沸点在三个当中最高,CO2和CS2都是分子晶体,CS2相对分子质量大,沸点较高。
本题难度:一般
4、选择题 下列各组物质中,按熔点由低到高排列正确的是(?)
A.O2、I2、Hg
B.CO2、KCl、SiO2
C.HF、HCl、HI
D.SiO2、NaCl、SO2
参考答案:B
本题解析:A、Hg常温下为液态,所以三者的熔点由低到高排列O2、Hg、I2,错误;B、CO2属于分子晶体,熔点最低,KCl属于离子晶体,熔点低于原子晶体,SiO2属于原子晶体,熔点最高,正确;C、HF分子间存在氢键,熔点最高,错误;D、SiO2属于原子晶体,熔点最高,错误,答案选B。
本题难度:一般
5、填空题 (1)H+可与H2O形成H3O+,H3O+中O原子采用_______杂化,其键角比水分子_______(填“大”或“小”)。
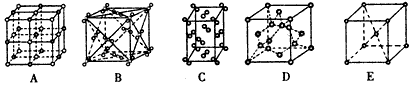
(2)下列是钠、碘、金刚石、干冰、氯化钠晶体的晶胞示意图(未按顺序排序)。上述五种晶体中晶体类型相同的是______________;(填写编号)。
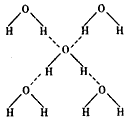
(3)在冰的晶体中,每个水分子与相邻的4 个水分子形成氢键(如图所示),已知冰的升华热(即1 mol 水由冰转化为水蒸汽所需能量)是51KJ/mol,除氢键外,水分子间还存在范德华力(11 kJ/mol ) ,则冰晶体中氢键的“键能”(破坏1mol 氢键所需的能量即为氢键的“键能”)是________kJ/mol 。
(4)CaO与NaCl的晶胞同为面心立方结构,已知CaO晶体密度为ag·cm-3,表示阿伏加德罗常数,则CaO晶胞体积为_______cm3。
(5)在酸性溶液中,发生的氧化还原反应中被氧化与被还原的的元素的物质的量之比为2:5,
①___KBiO3+_____MnSO4+_____H2SO4==_____Bi2(SO4)3+_______+_______+_______
②写出Bi同主族第四周期元素的电子排布式:___________________。
参考答案:(1)sp3;大?
(2)BC
(3)20
(4)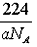
(5)①10KBiO3+4MnSO4+14H2SO4==5Bi2(SO4)3+4KMnO4+14H2O+3K2SO4;
②1s22s22p63s23p63d104s24p3
本题解析:
本题难度:一般