微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列物质露置于空气中易变质的是
①氯水 ②水玻璃 ③烧碱 ④漂白粉 ⑤绿矾 ⑥亚硫酸钠
A.除⑤外
B.除②③外
C.除②③⑥外
D.全部易变质
参考答案:D
本题解析:①氯水中的次氯酸易分解,②Na2SiO3易与空气中的CO2和水反应,③烧碱易与空气中的CO2反应,④漂白粉中的次氯酸钙易与空气中的CO2和水反应生成次氯酸,次氯酸易分解,⑤中的Fe2+和⑥中SO易被氧气氧化。
本题难度:简单
2、实验题 在实验室里可用右图所示装置制取氯酸钾、次氯酸钠和探究氯水的性质。
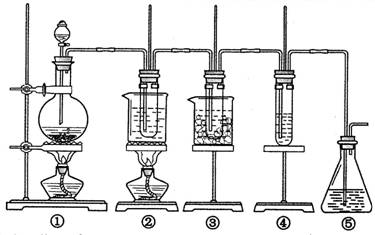
图中:①为氯气发生装置;②的试管里盛有15 mL 30% KOH溶液,并置于热水浴中;③的试管里盛有15 mL 8% NaOH溶液,并置于冰水浴中;④的试管里加有紫色石蕊试液;⑤为尾气吸收装置。请填写下列空白:
(1)装置①是氯气发生装置,蒸馏烧瓶中盛放MnO2固体,其反应的化学方程式为?。
(2)如果实验室中MnO2用完了,则下列物质可能可以用来代替MnO2制Cl2的是:?
A.NaBiO3? B.FeCl3? C.PbO2?
已知氧化性强弱顺序为:NaBiO3>PbO2>MnO2>FeCl3
(3)比较制取氯酸钾和次氯酸钠的条件,二者的差异是
①?;②?。
(4)反应完毕经冷却后,②的试管中有大量晶体析出。右图中符合该晶体溶解度曲线的是?(填写编号字母);从②的试管中分离出该晶体的方法是?(填写实验操作名称)。
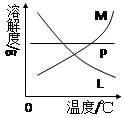
(5)根据④的试管里紫色石蕊试液的颜色变化可否证明氯气的强氧化性?。为什么??。
(6)一定量的氢气在氯气中燃烧,所得的混合物用100mL 3.00mol/L的NaOH溶液(密度为1.2g/mL)恰好完全吸收,测得溶液中含有NaClO的物质的量为0.0500mol。所得溶液中Cl-离子的物质的量??。
参考答案:(1)MnO2+4HCl(浓)  MnCl2+Cl2↑+2H2O?(2)A、C?
MnCl2+Cl2↑+2H2O?(2)A、C?
(3)①制取温度不同;? ②制取时碱的浓度也不同?(4)M?过滤
(5)不可,石蕊溶液褪色的是因为HClO的强氧化性而不是Cl2?(6)0. 250mol
本题解析:(1)实验室制氯气的反应为MnO2+4HCl(浓)  MnCl2+Cl2↑+2H2O。
MnCl2+Cl2↑+2H2O。
(2)根据氧化性的强弱可知比MnO2氧化性强的NaBiO3和PbO2都可以制氯气。
(3)比较②③两个装置中所装药品可知,制取氯酸钾和次氯酸钠的差别是:制取温度不同,制取时碱的浓度也不同。
(4)溶解度随温度变化较大的物质冷却后有晶体析出,所以M符合。分离的方法是过滤。
(5)氯气褪色,是因为氯水中的HClO有强氧化性和漂白性,所以不能证明氯气有强氧化性。
(6)100mL 3.00mol/L的NaOH溶液恰好完全反应,根据原子守恒,说明溶液中n(Cl-)+n(ClO-)=0.3mol。又知溶液中n(ClO-)=0.05mol,所以n(Cl-)=0.25mol。
点评:本实验题难度较大,综合性较强,有利于对学生解题思维的锻炼。
本题难度:一般
3、实验题 用MnO2和浓盐酸制取纯净干燥的氯气,并让氯气与铜粉反应制取纯净的无水CuCl2,装置如下图所示。

请回答下列问题:
(1)A 中发生反应的化学方程式为?
(2)B中选用的试剂是饱和食盐水,其作用是除去Cl2中的杂质?;C中选用的试剂是?,其作用是除去Cl2中的?
(3)E装置发生反应的离子方程式是?
(4)用含HCl 14.6g的浓盐酸与足量的MnO2反应产生氯气的物质的量应______0.1mol(填大于、小于或等于)
参考答案:(10分)(1)MnO2+4HCl(浓) MnCl2+Cl2↑+ H2O
MnCl2+Cl2↑+ H2O
(2)HCl?浓硫酸?水蒸气
(3)Cl2+2OH-==Cl- +ClO- + H2O?
(4)<
本题解析:(1)A装置是制取Cl2,化学方程式为MnO2+4HCl(浓) MnCl2+Cl2↑+ H2O。
MnCl2+Cl2↑+ H2O。
(2) 饱和食盐水除去HCl;C装置的作用是干燥Cl2,用的是浓硫酸,其作用是除去Cl2中的水蒸气。
(3)E装置是吸收多余的Cl2,离子方程式是Cl2+2OH-==Cl- +ClO- + H2O。
(4)反应过程中浓盐酸的浓度越来越稀,就不反应生成Cl2,故用含HCl 14.6g的浓盐酸与足量的MnO2反应产生氯气的物质的量应小于0.1mol。
点评:本题考查了气体的制取、净化、检验、收集、尾气处理装置,制取气体的反应装置类型有:固体、固体加热型,如制取氨气;固体、液体加热型,如制取氯气;固体、液体不加热型,如制取氢气等,根据反应物的状态、条件选择不同的反应装置。
本题难度:一般
4、选择题 能使溶液中溴离子数目显著增加的是(?)
A.把Cl2通入NaBr溶液中
B.将溴水滴到过量的AgNO3溶液中
C.向NaBr溶液中滴加过量溴水
D.把液溴滴到NaOH溶液中
参考答案:D
本题解析:在A选项中,发生Cl2+2NaBr====2NaCl+Br2;
在B选项中,发生Br-+Ag+====AgBr↓;
溴水不与NaBr反应,溴水不能显著增加Br-的浓度;
在D选项中,发生Br2+2NaOH====NaBr+NaBrO+H2O。
本题难度:简单
5、选择题 (10分)元素氯及其化合物在生产、生活、科研中有广泛的应用。
⑴25℃时,PbCl2固体在不同浓度盐酸(mol·L-1)中的
溶解度(mmol·L-1)如右图。
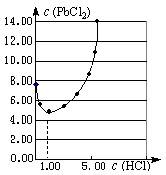
①在制备PbCl2的实验中,洗涤PbCl2固体最好选用?。
a.蒸馏水? b.1mol·L-1盐酸
c.5 mol·L-1盐酸? d.10mol·L-1盐酸
②当盐酸的浓度小于1mol·L-1时,随着盐酸浓度的增大,? PbCl2的溶解度减小,其原因是?。
⑵TCCA广泛用于漂白、杀菌消毒,其学名为三氯均三嗪-2,4,6-三酮,分子式为C3Cl3N3O3。
①TCCA分子具有完全对称的结构,并含有一个六元环,则其结构简式为?。
②使用TCCA时,需先将该物质溶解于水,其水解产物之一为C3H3N3O3,另一种产物具有强氧化性,能够杀菌消毒。写出另一种产物的电子式?。
⑶高氯酸铵(AP)作为一种优良的固体推进剂被用于导弹和火箭发射。目前,较为先进的制备方法是电解高纯次氯酸得到高纯高氯酸,再与高纯氨进行喷雾反应制成高氯酸铵。写出由次氯酸电解制备高氯酸的阳极反应式:?。
参考答案:⑴①b?②Cl-浓度增大,PbCl2的溶解平衡逆向移动
⑵①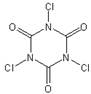 ?②
?②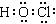
⑶①HClO+3H2O-6e-=ClO4—+7H+(每空2分,共10分)
本题解析:略
本题难度:一般