| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高考化学知识点总结《离子共存》高频考点巩固(2017年模拟版)(十)
参考答案:A 本题解析:A、c(H+)=1×10-14mol/L的溶液呈碱性,各离子互不反应,可以大量共存,故A正确;B、HClO与CO32?反应生成ClO?和HCO3?,不能大量共存,故B错误;C、能与Al反应生成H2的溶液可能为酸性,也可能为碱性,酸性时,H+、NO3?能氧化I?,碱性时OH?与NH4+反应,不能大量共存,故C错误;D、CO32?、AlO2-水解使溶液呈碱性,不能在中性溶液中存在,故D错误。 本题难度:一般 2、选择题 在强碱性溶液中,下列各组离子能大量共存的是( ) |
参考答案:D
本题解析:离子间如果发生化学反应,则不能大量共存,反之是可以的。溶液显碱性,则HCO3-、 Cu2+分别不能大量共存,所以答案选D。
本题难度:困难
3、选择题 下列说法正确的是(?)
A.相同物质的量浓度的下列溶液中,①NH4Al(SO4)2、②NH4Cl、③CH3COONH4、④NH3·H2O;
c(NH4+) 由大到小的顺序是:①>②>③>④
B.某物质的溶液中由水电离出的c(H+)=1×10-a mol/L,若a>7时,则该溶液的pH一定为14-a
C.物质的量浓度相等的H2S和NaHS混合溶液中:c(Na+) +c(H+) =" c" (S2―) +c (HS―)+c (OH―)
D.AgCl悬浊液中存在平衡: AgCl(s) 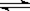 Ag+(aq)+Cl―(aq),往其中加入少量 NaCl粉末,平衡会向左移动,溶液中离子的总浓度会减小
Ag+(aq)+Cl―(aq),往其中加入少量 NaCl粉末,平衡会向左移动,溶液中离子的总浓度会减小
参考答案:A
本题解析:氨水部分电离出NH4+,所以四种溶液中c(NH4+)最小。硫酸铝铵中Al3+水解呈酸性,抑制NH4+水解、醋酸铵中CH3COO-水解呈碱性,促进NH4+水解、氯化铵中Cl-对NH4+水解无影响,所以四种溶液中c(NH4+)由大到小的顺序是①>②>③>④,A正确;水电离出的c(H+)=1×10-a mol/L,若a>7时,则该溶液的pH为14-a或a,B错误;H2S与Na2S混合溶液中电荷守恒式为c(Na+) +c(H+) =" 2c" (S2―) +c (HS―)+c (OH―),C错误;AgCl悬浊液中加入NaCl固体,沉淀溶解平衡向左移动,c(Ag+)减小、c(Cl-)增大,c(Na+)增大,D错误。
点评:分析不同溶液中同种离子浓度大小时,要看其它离子对该离子的影响;酸、碱抑制水的电离,能水解的盐促进水的电离。
本题难度:困难
4、选择题 下列各组离子能大量共存,且溶液为无色透明的是( )
A.Al3+、AlO2-、NO3-、Cl-
B.CrO42-、H+、K+、NO3-
C.Ba2+、Na+、HCO3-、OH-
D.K+、SO42-、S2-、Na+
参考答案:D
本题解析:A.Al3+与AlO2-不能大量共存,互相促进水解,A错误;B.CrO42-是黄色溶液,B错误;C.HCO3-与OH-
反应生成碳酸根离子和水,不能大量共存,C错误;D.能大量共存,D正确;答案选D
考点:离子共存
本题难度:一般
5、选择题 某溶液中加入铝片有氢气产生,则该溶液中一定能大量共存的离子组是
A.Cl― NO3― Ba2+ Fe3+
B.SO42― S2― Al3+ Mg2+
C.Na+ K+ SO42― Cl―
D.NH4+ Ba2+ Cl― HCO3―
参考答案:C
本题解析:加入铝片有氢气产生,说明该溶液可能是酸溶液,也可能是碱溶液。
A错误,铁离子不能在碱溶液中大量存在,要生成氢氧化铁沉淀。
B错误,硫离子不能在酸性溶液中大量共存,镁离子和铝离子不能在碱性溶液中大量存在。
C正确。在酸,碱溶液中都可以大量存在。
D错误,铵根离子不能在碱溶液中大量存在,碳酸氢根离子不能在酸溶液中大量存在,也不能在碱溶液中大量存在。
本题难度:简单
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高考化学试题《氯及其化合物》高.. | |