微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (11分)过氧化钙(CaO2)难溶于水,在常温下稳定,在潮湿空气及水中缓慢分解放出氧气, 因而广泛应用于渔业、农业、环保等许多方面。下图是以大理石(主要杂质是氧化铝)等为原料制取过氧化钙(CaO2)的流程。
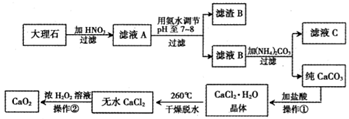
请回答下列问题:
(1)①中实验操作顺序为?(填序号)。
a.过滤? b.蒸馏? C.分液? d.蒸发结晶
(2)用氨水调节pH至7~8的目的是?。?
(3)写出生成滤渣B的离子方程式?。
(4)若在滤液C中,加入HNO3,使溶液呈酸性以得到副产物NH4NO3,则酸化后溶液中,
c(NH4+)?c(N03-)(填“≥”、“≤”、“<”、“>”或“=”)
(5)操作②是在低温下,往过氧化氢浓溶液中投入无水氯化钙进行反应,写出该反应的化学方程式?。一段时间后,再加入氢氧化钠溶液,调节溶液的pH至9~11, 出现大量沉淀。用简要的文字解释需用氢氧化钠调节pH至9~ll的原因?。
参考答案:(1)da(2分)(2)除去Al3+(1分)(3)Al3++3NH3?H2O= Al(OH)3↓+3NH4+,(2分)
(4)<(2分)(5)CaCl2+H2O2CaCl2+H2O2=CaO2+2HCl(或CaCl2+H2O2+2NaOH=2NaCl+2H2O+CaO2↓)(2分),加人氢氧化钠使上述平衡向右移动,有利于CaO2沉淀的生成。(2分)
本题解析:本题属于工业流程题,解题时要弄清楚每步操作的目的,从而理清思路:发生的反应有哪些(反应物、生成物是什么)、物质如何分离、提纯、制备、为什么要这样处理等。操作①加盐酸将碳酸钙溶解,然后蒸发析出晶体再过滤得CaCl2? H2O,用氨水pH至7~8的目的是将Al3+沉淀而分离出去,滤渣B为Al(OH)3,滤液C含NH4NO3、(NH4)2CO3,加入HNO3后得NH4NO3,由题意知c(NH4+)<c(N03-),(5)根据流程及质量守恒定律知反应为:CaCl2+H2O2CaCl2+H2O2=CaO2↓+2HCl,因此加氢氧化钠的目的是中和盐酸使上述平衡向右移动,有利于CaO2沉淀的生成。(考查学生思考加氢氧化钠与反应混合物有无作用,出现大量沉淀说明了什么等思维能力)。
本题难度:一般
2、推断题 a、b、c、d、e是含有一种相同元素的五种物质,可发生如下转化:

其中:?a是单质;b是气体;c、d是氧化物;e是最高价氧化物对应的水化物。
(1)如果a是一种淡黄色粉末固体,试推断这五种物质(用名称表示):
a_______;b_______;c_______;d________;e________。
(2)如果a是一种常见气体,试推断这五种物质(用化学式表示):
a_______;b_______;c_______;d________;e________。
参考答案:(1)硫;硫化氢;二氧化硫;三氧化硫;硫酸
(2)N2;NH3;NO;NO2;HNO3
本题解析:
本题难度:一般
3、填空题 下图所示各步变化,A为金属,B为淡黄色固体粉末,每一物质均含有A元素。(8分)
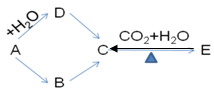
(1)?写出下列物质的化学式:B?C?D?E?
(2)?写出下列步骤的化学反应方程式
A→B:?
B→C:??
(3)?写出下列步骤的离子反应方程式
A→D:??
参考答案:(1)B Na2O2? C Na2CO3? D? NaOH? E? NaHCO3?(每空0.5分)
(2). A→B:? 2Na + O2 Na2O2 ?(2分)
Na2O2 ?(2分)
B→C:? 2Na2O2?+ 2CO2?= 2Na2CO3?+ O2(2分)
(3). A→D:? 2 Na+2H2O? = 2Na+ +2OH-? + H2 ↑ (2分)
本题解析:中学化学中只有Na2O2和S为淡黄色粉未,且已知A为金属,所以得到,B为Na2O2,A为Na,? D为NaOH ,由B ,D都可转化为C,且E在加热的条件下生成C,得C为Na2CO3?,E为NaHCO3。
点评:本题以化学推断题的形式考查了钠及其化合物之间的转化,而做推断题的重点就是找到突破口,本题其中,淡黄色粉未就是本题的突破口,而对钠与其化合物之间的转化的掌握是解答本题的基础。
本题难度:一般
4、填空题 有A、B、C三种常见的金属单质,A在空气中燃烧生成淡黄色固体;B也能在空气中剧烈燃烧,发出耀眼的白光;C在一定条件下与水蒸气反应生成H2和一种黑色固体。根据以上信息回答下列问题:
(1)写出化学式A??B??C??
(2)写化学方程式①A在空气中燃烧?
②C与水蒸气反应?
③A与水反应?
参考答案:(1)A? Na??B? Mg??C? Fe??
(2)①? ?
?
②?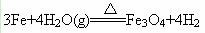 ?
?
③? 2Na+2H2O===2NaOH+H2↑?
本题解析:略
本题难度:简单
5、简答题 已知A、B为气体单质,其中A为黄绿色气体,B为无色气体;C为化合物,其水溶液的pH小于7;D为金属单质,它们之间有下列转化关系:

(1)试写出A、B、C、D的化学式:
A______;B______;C______;D______.
(2)写出C的水溶液与D反应的离子方程式:______;
E溶液与A反应的离子方程式:______;
F+D反应的离子方程式:______.
参考答案:A、B为气体单质,其中A为黄绿色气体,B为无色气体;C为化合物,其水溶液的pH小于7,则A为Cl2,B为H2,C为HCl;D为金属单质,结合E与氯气反应,D与F反应,则D为变价金属,则D为Fe,所以E为FeCl2,F为FeCl3,
(1)由上述分析可知,A为Cl2,B为H2,C为HCl,D为Fe,故答案为:Cl2;H2;HCl;Fe;?
(2)C的水溶液与D反应的离子方程式为2H++Fe=H2↑+Fe2+,E溶液与A反应的离子方程式为2Fe2++Cl2=2Fe3++2Cl-,F+D反应的离子方程式为2Fe3++Fe=3Fe2+,
故答案为:2H++Fe=H2↑+Fe2+;2Fe2++Cl2=2Fe3++2Cl-;2Fe3++Fe=3Fe2+.
本题解析:
本题难度:一般