微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (16分)A、B、C、D都是中学化学中的常见物质,其中A、B、C均含有同一种元素,在一定条件下相互转化关系如下(部分反应中的水已略去)。
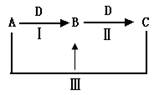
(1)若A是一种强碱,C为厨房中的用品。
①反应Ⅲ的离子方程式是__________________________________。
②下列有关B、C的说法正确的是?
A.向B的饱和溶液中通入D,将有晶体析出
B.可以用BaCl2或CaCl2稀溶液或Ba(OH)2稀溶液鉴别B、C两种溶液
C.分别取等质量的B、C两种固体与足量盐酸反应C产生气体多
D.取a克B、C的混合物充分加热,固体质量减重b克,由此可计算出混合物中B的质量分数
E.取a克B、C的混合物与足量稀硫酸充分反应,逸出的气体用碱石灰完全吸收,增重b克, 由此可计算出混合物中B的质量分数
(2)若A、D均为单质,且A为气体,D元素的一种红棕色氧化物常用作颜料。
①反应Ⅲ的离子方程式是__________________________________。
②向沸水中逐滴加入5~6滴B的饱和溶液,继续煮沸至溶液呈红褐色,该反应的化学方程式为:?。区分该分散系与其它分散系最本质的特征是?。
⑶若常温下A、C是气体,B是固体。
①反应Ⅲ的化学方程式是__________________________________.
有两瓶经过C气体和(2)中的A气体漂白的品红溶液,如何通过简单实验进行鉴别??
?
?。
③在BaCl2溶液中通入C气体,未见沉淀生成,若先通入下列的另一种气体,再通入C;或者向通入C气体的BaCl2溶液中加入下列物质,可以看到沉淀的有_______(填序号)。
A、Cl2? B、NH3? C、HCl? D、CO2?E、KNO3?
参考答案:(16分,每空2分)(1)①HCO3-+OH-="==" H2O+CO32-?②ACD
(2)①Cl2+2Fe2+===2Cl-+2Fe3+? ②FeCl3+3H2O ?Fe(OH)3(胶体)+3HCl
?Fe(OH)3(胶体)+3HCl
分散质微粒直径在1~100 nm之间。
(3)①SO2+2H2S===3S↓+2H2O
②分别取少量经漂白的品红溶液于试管中,加热,恢复红色的是经过C气体漂白的品红溶液,不能恢复红色的是经过(2)中的A气体漂白的品红溶液
③ABE
18、
本题解析:本题为开放性试题,由转化关系,我们很容易想到,①连续氧化、②碱、正盐、酸式盐等。(1)A为强碱,为NaOH、Na2CO3、NaHCO3;(2)D红棕色颜料为Fe2O3,故A:Cl2、D:Fe;(3)C气体漂泊品红,并与Cl2的原理不一样,为SO2,改组为连续氧化得到:H2S→S→SO2。
本题难度:一般
2、填空题 (16分)已知A、B、C、D、E、G、H、I均为气体,J为常见的液态物质,A、B、C、I、M为单质,且M为常用金属,G和H相遇时产生白烟,它们存在如下的转化关系(图中部分反应物或产物已省略),请回答有关问题:
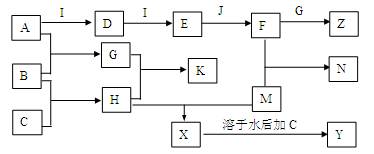
(1)A分子的电子式是?,G分子的空间构型为?。
(2)常温下,pH值均为5的H溶液和K溶液中由水电离的c(H+)之比为?。
(3)若向X的水溶液中通入G,产生的现象是?,N与X中都含M的元素,其化合价是否相同?。
(4)写出X+C→Y的离子方程式?。
M与气态J在高温时反应的化学方程式是?。
(5)土壤胶粒带负电,含相同质量A元素的Z和K施用到稻田后,效果更好的是? -?(填化学式)。
(6)在通常状况下,若1 g B气体在C气体中燃烧生成H气体时放出92.3 kJ热量,则2 mol H气体完全分解生成C气体和B气体的热化学方程式为?。
参考答案:(16分)(1)∶N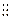 N∶(1分)?三角锥型(1分)(2)1*10-4(2分)。
N∶(1分)?三角锥型(1分)(2)1*10-4(2分)。
(3)先产生白色沉淀,又迅速变为灰绿色,最后变为红褐色(2分)不一定相同(2分)
(4)2Fe2++Cl2=2Cl-+2Fe3+(2分)? 3Fe+4H2O Fe3O4+4H2?(2分)
Fe3O4+4H2?(2分)
(5)NH4Cl(2分)?
?
本题解析:略
本题难度:一般
3、推断题 已知D、M、H是常见的非金属单质,其中M是无色气体,H是黄绿色气体。J是一种金属单质,J元素的+2价化合物比+4价化合物稳定。D、J元素在周期表中同主族,D是形成化合物种类最多的元素。A、C是金属氧化物,C和J 均是某种常见电池的电极材料,B与C反应时,每生成l mol H同时消耗4 moI B和1 mol C。它们之间的关系如图
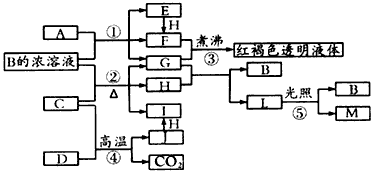
(1)写出物质A的化学式_________,CO2的电子式为_________。
(2)写出反应②的化学方程式______________________。
(3)向框图中的红褐色透明液体中逐滴滴入HI溶液,可以观察到先产生红褐色沉淀,后红褐色沉淀溶解,红褐色沉淀溶解的离子方程式为________________________。
(4)由金属氧化物A和C得到其相应的金属单质,在冶金工业上一般可用__________方法(填序号);
①热分解法②热还原法③电解法
其中从A得到其相应金属单质也可用铝热法,若反应中1 mol A参加反应,转移电子的物质的量为_______
mol。
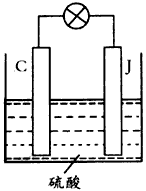
(5)用C、J作电极,与硫酸构成如图所示电池,工作时电池的总反应式为_________________,当反应转移1 mol电子时,溶液中消耗H+的物质的量为____mol。
参考答案:(1)Fe3O4;
(2)PbO2+4HCl(浓) PbCl2+Cl2↑+2H2O
PbCl2+Cl2↑+2H2O
(3)2Fe(OH)3+2I-+6H+=I2+2Fe2++6H2O
(4)②;8
(5) Pb+PbO2+2H2SO4 =2PbSO4 +2H2O;2
本题解析:
本题难度:一般
4、推断题 图中各物质均由常见元素(原子序数≤20)组成。已知A、B、K为单质,且在常温下A和K为气体,B为固体。D为常见的无色液体。I是一种常用的化肥,在其水溶液中滴加AgNO3溶液有不溶于稀HNO3的白色沉淀产生。J是一种实验室常用的干燥剂。它们的相互转化关系如图所示(图中反应条件未列出)。请回答下列问题

(1)I的化学式为_____________;J的电子式为__________________。
(2)反应①的化学方程式为_______________________________。
(3)F的水溶液与氯气反应的离子方程式为________________________________。
参考答案:(1)NH4Cl;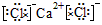
(2)Ca3N2+6H2O = 3Ca(OH)2+2NH3↑
(3)2OH-+Cl2 = Cl-+ClO-+H2O
本题解析:
本题难度:一般
5、推断题 A-J是中学化学中常见的几种物质,它们之间的转化关系如图所示。已知常温下A为固体单质,B为淡黄色粉末,C、F、I为气态单质,E在常温下为液体,且E可由C、F合成,J可用作杀菌消毒剂。回答下列问题
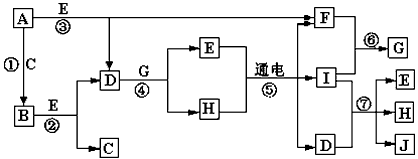
(1)B中的化学键有________(填“离子键”、“极性键”或“非极性键”) E的电子式________。
(2)写出反应⑦的离子方程式 __________________________。
(3)向AlCl3溶液中加入少量固体B,写出反应的化学方程式_____________________。
(4)常温下1克F单质在足量C单质中燃烧生成稳定的液态物质E释放出142.9kJ热量,写出液态E分解的热化学方程式________________。
(5)以Pt为电极电解滴加有少量酚酞的H饱和溶液,则在________(填“阴或阳”)极附近溶液由无色变为红色,其原因是________________。
参考答案:(1)离子键、非极性键;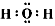 ?
?
(2)Cl2+2OH-=Cl-+ClO-+H2O
(3)4AlCl3+6Na2O2+6H2O=4Al(OH)3↓+12NaCl+3O2↑
(4)H2O(l) = H2(g) +1/2O2(g) △H=+285.8kJ/mol
(5)阴极;在阴极由于H+得到电子产生H2,破坏了水的电离平衡,促进水继续电离,导致溶液中
c(OH-)>c(H+),溶液呈碱性,所以阴极附近溶液变为红色
本题解析:
本题难度:一般