| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高中化学知识点大全《离子共存》考点特训(2017年冲刺版)(八)
参考答案:B 本题解析:由水电离产生的c (OH-)=1×10-14mol·L-1<10-7mol/L,受到抑制,是酸或碱溶液,A.Al3+ 与OH-反应不能大量共存,错误;B.K+ Na+ Cl- NO3-各离子能大量共存,正确;C.AlO2- 与H+反应不能大量共存,D.NH4+ 与OH-反应不能大量共存,错误;选B。 本题难度:一般 3、选择题 下列各组离子在指定环境下能大量共存的是 参考答案:C 本题解析:A选项中,S 本题难度:一般 4、选择题 常温下,下列各组离子在指定溶液中一定能大量共存的是 |
参考答案:A
本题解析:0. 1mol·L-1Na2CO3溶液,CO32-与Ba2+反应,生成碳酸钡沉淀,故B错误;0. 1mol·L-1FeCl3溶液,Fe3+与SCN-与不能共存、Fe3+的与I-因发生氧化还原反应不能共存,故C错误;由水电离的c(H+)=1.0×10-9 mol?L?1溶液,溶液呈强酸性或强碱性,HCO3-、不能存在,故D错误。
考点:本题考查离子共存。
本题难度:困难
5、填空题 (6分)某溶液中可能含有H+、Na+、NH4+、Mg2+、Fe3+、Al3+、SO42- 等离子,当向该溶液中加入某浓度的NaOH溶液时,发现生成沉淀的物质的量随NaOH溶液的体积变化如图所示,由此可知,该溶液中肯定含有的阳离子是___________________,且各离子的物质的量之比为___________________;肯定不含的阳离子是____________________。写出平行线段线所发生反应的离子方程式:?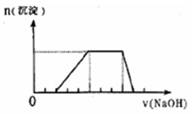
参考答案: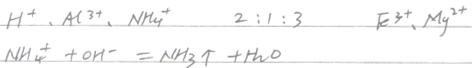
本题解析:由图,开始加入NaOH溶液,无沉淀生成则溶液中含有H+,再加入NaOH溶液有沉淀生成则溶液中可能有Mg2+、Fe3+、Al3+、,再加入NaOH溶液,沉淀不变化则溶液中有NH4+,再加入NaOH溶液,沉淀溶解最后消失则溶液中有Al3+无Mg2+、Fe3+;根溶液呈电中性的原则,可得H+,Al3+,NH4+,的物质的量之比为2:1:3;
本题难度:简单
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高考化学知识点整理《原电池原理.. | |