微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 如图为一恒压容器。在恒定温度下,将1 mol N2和3 mol H2混合后由A口快速充入容器,封闭A。反应N2+3H2? ?2NH3在t1时刻达到平衡;t2时刻再从A口快速充入一定量NH3,封闭A;t3时刻重新达到平衡至t4。在0→t4时间内混合气中NH3的体积分数(纵坐标)随时间(横坐标)变化的曲线正确的是( )
?2NH3在t1时刻达到平衡;t2时刻再从A口快速充入一定量NH3,封闭A;t3时刻重新达到平衡至t4。在0→t4时间内混合气中NH3的体积分数(纵坐标)随时间(横坐标)变化的曲线正确的是( )
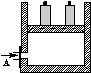 ?
?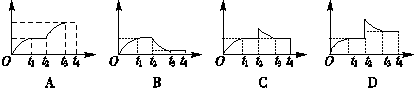
参考答案:C
本题解析:根据平衡的建立与途径无关,充入一定量的氨气若换算成反应物氮气和氢气,二者的体积是1︰3,与最初通入的体积比是一致的。因为反应是在等压下进行的,所以它们的平衡是等效的,即氨气的体积分数是相等的,答案选C。
本题难度:一般
2、计算题 在一个体积固定的密闭容器中加入反应物A,B,发生如下反应:A+3B=2C。反应经2 min后,A的浓度从开始时的1.20 mol/L下降到0.9 mol/L,已知B 的起始浓度为1.6 mol/L。求:
(1)2 min末B,C的浓度。
(2)以单位时间内B浓度的减小和C浓度的增加来表示2 min内该反应的平均速率。
参考答案:(1)2 min末B的浓度为0.7 mol/L,C的浓度 为0.6 mol/L。
(2)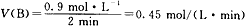 ;
;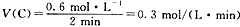
本题解析:
本题难度:一般
3、填空题 (7分)在某温度下合成氨:N2+3H2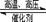 2NH3(△H<0),把N2和H2以1︰1的物质的量之比混匀后分成两等份,同时分别充入A体积和B体积两个装有催化剂的真空容器中(A、B两容器容积固定),在保持同温度下,A、B两个容器的合成氨反应先后达到平衡状态。请回答:
2NH3(△H<0),把N2和H2以1︰1的物质的量之比混匀后分成两等份,同时分别充入A体积和B体积两个装有催化剂的真空容器中(A、B两容器容积固定),在保持同温度下,A、B两个容器的合成氨反应先后达到平衡状态。请回答:
(1)写出该反应的平衡常数表达式:_____________,KA_____ _KB(填“>”、“<”或“=”)。
_KB(填“>”、“<”或“=”)。
(2)平衡常数K值越大,表明建立平衡时__________。
A.N2的转化率越低? B.NH3的产量越小
C.正反应进行得越彻底
(3)欲增大该反应K值,可以采取的措 施为__________。
施为__________。
A.升高温度? B.降低温度?
C.增大N2、H2的浓度? D.使用高效的催化剂
(4)分析下表中数据后,完成下列问题[M(平)表示平衡 时混合物的平均相对分子质量]:达平衡时,容器A中N2的转化率为___________,容器B中M(平)为__________,容器______(填“A”或“B”)中,NH3的物质的量所占
时混合物的平均相对分子质量]:达平衡时,容器A中N2的转化率为___________,容器B中M(平)为__________,容器______(填“A”或“B”)中,NH3的物质的量所占 的比例较大。
的比例较大。
?
| 容器A
| 容器B
|
M(平)
| 20
| ?
|
平衡时N2的转化率
| ?
| 10%
参考答案:(1)K=c2(NH3) /[c(N2) c3(H2)],KA=KB。(2)C。(3)B。(4)25%,16.7,A。
本题解析:略
本题难度:简单
4、选择题 一定温度下在密闭容器内进行着某一反应,X气体、Y气体的物质的量随反应时间变化的曲线如图。下列叙述中正确的是

[? ]
A.?反应的化学方程式为5Y X X
B.?t1时,Y的浓度是X浓度的1.5倍
C.?t2时,正、逆反应速率相等
D.?t3时,逆反应速率大于正反应速率
参考答案:B
本题解析:
本题难度:简单
5、计算题 将3 mol A和2.5 mol B混合于2L的密闭容器中,发生反应的化学方程式为:3A(气) + B(气)  ?xC(气) + 2D(气),5 min后反应达到平衡状态,容器内的压强变小,已知D的平均反应速度为 0.1 mol/(L﹒min), 填写下列空白: ?xC(气) + 2D(气),5 min后反应达到平衡状态,容器内的压强变小,已知D的平均反应速度为 0.1 mol/(L﹒min), 填写下列空白:
(1) x =______
(2) 平衡时C的浓度为 ________________
(3) 平衡时B的转化率为 _____________
(4) 平衡时,容器内的压强与原容器内压强的比值为 ___________
参考答案:(1)X="1" ?(2) 0.25mol·L-1?(3)20%?(4)10∶11
本题解析:容器内的压强变小,说明3+1>x+2,又因为x是整数,所以x=1。D的平均反应速度为 0.1 mol/(L﹒min),,则生成D是0.1 mol/(L﹒min),×2L×5min=1.0mol
3A(气) + B(气)  ?C(气) + 2D(气) ?C(气) + 2D(气)
起始量(mol)? 3? 2.5? 0? 0
转化量(mol)? 1.5? 0.5? 0.5? 1.0
平衡量(mol)? 1.5? 2.0? 0.5? 1.0
所以平衡时C的浓度为0.5mol÷2L=0.25mol/L
平衡时B的转化率为0.5÷2.5×100%=20%
因为压强之比是物质的量的之比
所以平衡时,容器内的压强与原容器内压强的比值为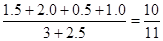
本题难度:一般
|