微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列电子式中,正确的是( )?
参考答案:C
本题解析:本题考查电子式的书写,A选项Cl-应写成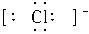 形式。B中
形式。B中 的电子式错误,D中Cl-的电子式应用[ ]括起来,只有C选项正确。?
的电子式错误,D中Cl-的电子式应用[ ]括起来,只有C选项正确。?
本题难度:一般
2、选择题 现有四种晶体,其构成粒子(均为单原子核粒子)排列方式如下图所示,其中化学式正确的是
[? ]
A. 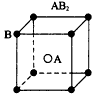
B. 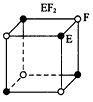
C. 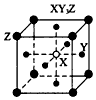
D. 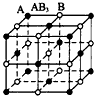
参考答案:C
本题解析:
本题难度:一般
3、选择题 NaCl的晶胞如图所示,将NaCl晶胞中的所有Cl-去掉,并将Na+全部换成C原子,再在晶胞的4个“小立方体”中心处各放置一个C原子,且这四个“小立方体”互不共面,位于“小立方体”中的碳原子均与最近的4个碳原子成键,以此表示金刚石的一个晶胞。若再将在成键的C原子中心联线的中点处增添一个O原子,则构成了某种CO2的晶胞。则下面说法正确的是(?)(已知C-C键的键长1.54×10-10m)
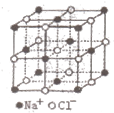
A.一个金刚石的晶胞中有8个C原子
B.金刚石的密度为3.54g·cm-1
C.在该种CO2晶体中,一个CO2分子由一个C原子和二个氧原子构成
D.在该种CO2晶胞中含氧原子8个
参考答案:AB
本题解析:根据题意,给出金刚石晶胞,如右图:金刚石晶胞中C原子数为4.;计算方式是8个黑色的一共是1个C,6个蓝色的一共是3个C,加起来是4?个。绿色的在晶胞里面,应该有4个C,加起来有8个。A正确;体对角线的1/4是C-C键长,体对角线是0.154×4=0.616nm,正方体体对角线是正方体边长的√3倍,因此,正方体边长=0.616/√3=0.356nm,? 1mol金刚石质量12g,,含6.02×1023个C原子,一个金刚石晶胞体积是(0.356 × 10-7)3立方厘米,而每个晶胞内含8个C原子,所以共有(6.02×1023)/8个晶胞,因而12g金刚石的总体积是(6.02×1023)/8×[0.356×10-7]3立方厘米,两者相除就得出密度,是3.503g·cm-3。B正确。C.在该种CO2晶体中,无CO2分子,C错误;D.在该种CO2晶胞中含氧原子16个,D错误。
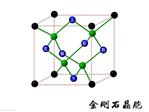
本题难度:一般
4、填空题 氧元素与多种元素具有亲和力,所形成化合物的种类很多。
(1)氮、氧、氟元素的第一电离能从大到小的顺序为?。
(2)根据等电子原理,在NO2+离子中氮原子轨道杂化类型是?; 1 mol O22+中含有的π键数目为?。氧元素与氮元素能形成多种分子,试写出与N2O分子互为等电子体的一种阴离子?。
(3)氧元素和过渡元素可形成多种价态的金属氧化物,如和铬可生成Cr2O3、CrO3、CrO5等。Cr3+基态核外电子排布式为?。
(4)钙在氧气中燃烧时得到一种钙的氧化物晶体,其晶体结构如图所示,则该钙的氧化物的化学式为?。
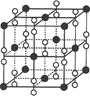
参考答案:(12分)(1)F> N> O(2分)?(2)sp(2分) ?2NA(2分)? SCN—(2分)
(3)1s22s22p63s23p63d3(2分)?(4)CaO2(2分)
本题解析:(1)非金属性越强,第一电离能越大。但由于氮元素的2p轨道电子处于半充满状态,稳定性强,所以氮元素的第一电离能大于氧元素的,则氮、氧、氟元素的第一电离能从大到小的顺序为F>N>O。
(2)价电子数和原子数分别都相等的是等电子体,则与NO2+离子互为等电子体的是CO2。CO2是含有双键的直线型结构,所以根据等电子原理,在NO2+离子中氮原子轨道杂化类型是sp杂化;与O22+离子互为等电子体的是氮气。氮气含有三键,而三键是由1个α键和2个π键构成的,则1 mol O22+中含有的π键数目为2NA。与N2O分子互为等电子体的一种阴离子SCN—。
(3)根据构造原理可知,Cr3+基态核外电子排布式为1s22s22p63s23p63d3。
(4)根据晶胞的结构可知,黑球表示钙离子,其个数=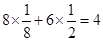 个。阴离子是由2个氧原子构成的,其个数是
个。阴离子是由2个氧原子构成的,其个数是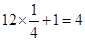 ,所以钙氧化物的化学式是CaO2。
,所以钙氧化物的化学式是CaO2。
点评:该题是高考中的常见题型,属于中等难度的试题。试题综合性强,侧重对学生能力的培养和解题方法的指导与训练,旨在考查学生灵活运用基础知识解决实际问题的能力,有利于培养学生的应试能力和逻辑推理能力。该题以“周期表中元素的推断”为载体,比较全面考查学生有关元素推断知识和灵活运用知识的能力。考查学生对元素周期表的熟悉程度及其对表中各元素性质和相应原子结构的周期性递变规律的认识和掌握程度。考查了学生对物质结构与性质关系以及运用元素周期律解决具体化学问题的能力。
本题难度:一般
5、填空题 (15分)
镁、钙、钾、溴、氟、硼等元素在每升海水中的含量都大于1 mg ,属于海水中的常量元素。
⑴镓与硼同主族,写出镓元素原子的价电子排布式?。
⑵钾、钙、镓的第一电离能从大到小的顺序是?。
⑶比较氟化钠和溴化钠的熔点:氟化钠?溴化钠(填“<”或“>”),分析其原因是?。
⑷举出两例说明锂与镁具有相似性:①?、②?,这种相似性称为?。
⑸用价层电子对互斥理论推断BF3空间构型为?,NF3分子中N原子的杂化轨道类型为?;在NH3·BF3中接受孤对电子的原子是?。
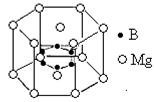
⑹2001年曾报道,硼镁化合物刷新了金属化合物超导温度的最高记录。该化合晶体结构中的晶胞如上图所示。镁原子间形成正六棱柱,且棱柱的上下底面还各有一个镁原子,六个硼原子位于棱柱内。则该化合物的化学式可表示为?。
参考答案:(15分)
⑴4s24p1?(2分)?⑵钙>镓>钾(2分)
⑶>(1分)?由于两晶体的晶格能:氟化钠大于溴化钠。(1分)
⑷任选两个作答。★锂和镁在过量的氧气中燃烧均生成氧化物,而不是过氧化物。★锂、镁都能与氮气直接化合而生成氮化物。★锂、镁与水反应均较缓慢。★锂、镁的氢氧化物都是中强碱,溶解度都不大,在加热时分解为Li2O和MgO。★锂、镁的碳酸盐均难溶于水。(2分)?对角线规则(2分)
⑸平面正三角形? sp3 ?B?(3分)?⑹MgB2?(2分)
本题解析:略
本题难度:一般