|
|
|
高考化学知识点总结《水的电离平衡》答题技巧(2017年最新版)(八)
2017-09-25 16:27:48
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列电离方程式中,正确的是
[? ]
A.HClO4 == H++ClO4-
B.H2CO3 2H++CO32- 2H++CO32-
C.H2PO4-+H2O== HPO42-+H3O+
D.NH3·H2O == NH4++OH-
参考答案:A
本题解析:
本题难度:一般
2、选择题 在0.1 mol/L H2S溶液中,各微粒浓度大小比较正确的是
A.c(H+)>c(HS-)>c(S2-)>c(H2S)
B.c(H2S)>c(H+)>c(HS-)>c(S2-)
C.c(H2S)>c(H+)>c(S2-)>c(HS-)
D.c(H+)>c(H2S)=c(S2-)>c(HS-)
|
参考答案:A
本题解析:多元弱酸的电离是分步进行的,其中以第一步电离为主,即第一步电离的程度最大。由于0.1mol/L H2S溶液中存在下列平衡:H2S  H++HS-,HS- H++HS-,HS- H++S2-,H2O H++S2-,H2O  H++OH-,根据电荷守恒得c(H+)=c(HS-)+c(S2-)+c(OH-),根据物料守恒得c(H2S)+c(HS-)+c(S2-)="0.1" mol/L,又因为H2S溶液中第一步电离大于第二步电离,所以可知A选项正确。 H++OH-,根据电荷守恒得c(H+)=c(HS-)+c(S2-)+c(OH-),根据物料守恒得c(H2S)+c(HS-)+c(S2-)="0.1" mol/L,又因为H2S溶液中第一步电离大于第二步电离,所以可知A选项正确。
本题难度:简单
3、填空题 在水的电离平衡中,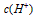 和 和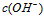 的关系如下图所示 的关系如下图所示
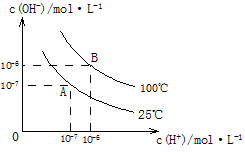
(1)A点水的离子积为1×10-14,B点水的离子积为____________________。造成水的离子积变化的原因是______________________。
(2)25℃时,H2R在水溶液中的电离方程式为: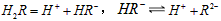 。 。
① 0.1 mol/LH2R溶液的pH________1(填“>”.“<”或“=”)。
②在0.1 mol/L 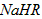 溶液中,各离子浓度由大到小的顺序是:_____________________。 溶液中,各离子浓度由大到小的顺序是:_____________________。
(3)100℃时,0.01 mol/L 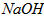 溶液的pH =_________________。 溶液的pH =_________________。
(4)100℃时,将pH =8的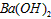 溶液与pH =5的稀盐酸混合,并保持100℃恒温,欲使混合溶液的pH= 溶液与pH =5的稀盐酸混合,并保持100℃恒温,欲使混合溶液的pH=
7,则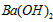 溶液与盐酸的体积比为____________________。 溶液与盐酸的体积比为____________________。
参考答案:(1)1×10-12;水的电离要吸热,温度升高,水的电离程度增大,即离子积增大
(2)①<;②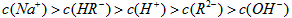
(3)10
(4)2:9
本题解析:
本题难度:一般
4、选择题 下列说法正确的是
A.水的电离过程是吸热过程,升高温度,水的离子积增大、pH减小
B.根据CO2通入漂白粉水溶液中,溶液先变浑浊后澄清,推断SO2通入也有同样现象
C.向1 mL浓度均为0.05 mol·L-1的NaCl、NaI混合溶液中滴加2滴0.01 mol·L-1的AgNO3溶液,振荡,沉淀呈黄色。结论:Ksp(AgCl)<Ksp(AgI)
D.将Fe(NO3)2晶体溶于稀硫酸,滴加KSCN溶液,通过观察溶液变红确定硝酸亚铁晶体已被氧化
|
参考答案:A
本题解析:A项水的电离过程为吸热过程,升高温度促进水的电离,水的离子积增大,pH减小;B项CO2通入漂白粉水溶液中发生反应:CO2+Ca(ClO)2+H2O=CaCO3+CO2↑+H2O,继续通入又会发生反应:CaCO3+CO2+H2O=Ca(HCO3)2↓,溶液又变澄清;C项同类型的难溶化合物,Ksp越小越容易生成,所以:Ksp(AgCl)>Ksp(AgI);D项溶液中含有H+ 、NO3-,也容易将Fe2+氧化为Fe3+,所以结论错误。
考点:水的电离、溶度积、物质的性质。
本题难度:一般
5、选择题 下列操作会促进H2O的电离,且使溶液pH>7的是
[? ]
A.将纯水加热到90℃
B.向水中加少量NaOH溶液
C.向水中加少量Na2CO3溶液
D.向水中加少量FeCl3溶液
参考答案:C
本题解析:
本题难度:一般