微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 有A、B、C、D、E五种短周期元素,已知A是构成化合物种类最多的元素,其原子最外层电子数是次外层电子数的2倍;E的最高正价和最低负价代数和为4;C与E同主族;B与D同主族;D+与氖原子具有相同的电子层结构;B元素原子的电子层数与族序数相等.试回答:
(1)元素符号:A______;B______;E______;
(2)写出C在元素周期表中的位置______;
(3)C、D、E原子半径由大到小的顺序是:______;(用元素符号表示)
(4)写出AC2的电子式:______;?B、C、D所形成的化合物的电子式______,并写出所含化学键的类型______;
(5)写出A和D两种元素的最高价氧化物发生氧化还原反应的化学方程式:______.
参考答案:(1)A是构成化合物种类最多的元素,其原子最外层电子数是次外层电子数的2倍,应为C元素,E的最高正价和最低负价代数和为4,则E为S元素,C与E同主族,应为O元素,D+与氖原子具有相同的电子层结构,则原子核外各层电子数分别为2、8、1,应为Na元素,B与D同主族,B元素原子的电子层数与族序数相等,应为H元素,
故答案为:C;H;S;
(2)C为O元素,原子核外有2个电子层,最外层电子数为6,则应位于第二周期第ⅥA族,故答案为:第二周期第ⅥA族;
(3)C为O元素,D为Na元素,E为S元素,Na与S位于同周期,同周期元素从左到右原子半径逐渐减小,则原子半径Na>S,
S比O元素多一个电子层,电子层数越多,半径越大,则半径S>O,所以原子半径Na>S>O,故答案为:Na>S>O;
(4)AC2对应的化合物为CO2,为共价化合物,电子式为
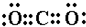
,B、C、D所形成的化合物为NaOH,为离子化合物,电子式为

,含有离子键和极性共价键,
故答案为:
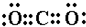
;

;离子键和极性共价键;
(5)A和D两种元素的最高价氧化物分别为CO2、Na2O2或Na2O,能发生氧化还原反应的为CO2和Na2O2,反应的化学方程式为2Na2O2+2CO2=2Na2CO3+O2,
故答案为:2Na2O2+2CO2=2Na2CO3+O2.
本题解析:
本题难度:简单
2、选择题 膦(PH3)又称磷化氢,在常温下是一种无色有大蒜臭味的有毒气体,电石气的杂质中常含有磷化氢。以下关于PH3的叙述正确的是
A.PH3分子的P-H键是非极性键
B.PH3比NH3稳定
C.PH3的分子构型是正四面体形
D.PH3分子中有未成键的孤对电子
参考答案:D
本题解析:A选项中P-H键由不同原子形成,为极性键。B由于N的氧化性大于P,所以NH3比PH3稳定。C中分子构型应为三角锥形。D选项正确,类比氨气的孤对电子。
点评:本题考查的物质可以用类比的方法来判断其性质,熟练运用元素周期律。
本题难度:一般
3、选择题 用价电子对互斥理论预测H2S和BF3的空间构型,两个结论都正确的是( )
A.直线形;三角锥形
B.V形;三角锥形
C.直线形;平面三角形
D.V形;平面三角形
参考答案:D
本题解析:
答案D,价电子对互斥理论预测,H2S和BF3分别采用sp3、sp2杂化,H2S有两对孤电子对,空间构型,BF3空间构型为平面正三角形
本题难度:简单
4、简答题 化学键的键能是指气态原子间形成1mol化学键时释放的能量.如:H(g)+I(g)=H-I(g);△H=-297kJ?mol-1,即H-I键的键能为297kJ?mol-1,也可以理解为破坏1mol?H-I键需要吸收297kJ的热量.化学反应的发生可以看成旧化学键的破坏和新化学键的形成.下表是一些键能数据.(单位:kJ?mol-1)
| 键能 | | 键能 | | 键能
H-H
436
Cl-Cl
243
C-F
427
H-N
393
H-O
?
H-F
565
C-Cl
330
H-S
339
H-Cl
431
C-O
347
C-I
218
H-Br
366
|
阅读上述信息,回答下列问题:
(1)你认为键能与物质的热稳定性的关系是:______.
所以CF4的化学稳定性比CCl4______(填“强”或“差”或“相同”)
(2)结合表中数据和热化学方程式H2(g)+Cl2(g)=2HCl(g)△H=-Q?kJ?mol-1;通过计算确定热化学方程式中Q的值为______.
(3)根据H-Br、H-Cl、H-F的键能大小比较,你能从原子结构方面得到什么结论:______.由此可推出H-O键的键能最佳估值范围为:______kJ?mol-1<E(H-O)<______kJ?mol-1.
参考答案:(1)键能越大,破坏该键越难,即该键越稳定;C-F键的键能大于C-Cl键的键能,所以CF4的化学稳定性比CCl4强.
故答案为:键能越大,物质的热稳定性越强;强.
(2)Q=生成物的键能减反应物的键能=2×431?kJ?mol-1-436kJ?mol-1-243kJ?mol-1=183kJ?mol-1
故答案为:183;
(3)根据图表知,H-Br、H-Cl、H-F的键能依次增大,Br、Cl、F的原子半径依次减小,键长依次减小,所以原子半径越小,形成的键长越短,键长越短键能越大;
根据原子半径与键长、键能的关系知,H-O键的键能应小于H-F键的、大于H-H减的键能.
故答案为:原子半径越小,形成的键长越短,键长越短键能越大;
393?kJ?mol-1<E(H-O)<565?kJ?mol-1
本题解析:
本题难度:一般
5、简答题 (12 分)揖选做题铱本题包括A、B 两小题,请选定其中一小题,并在相应的答题区域内作答。若多做,则按A 小题评分。
A. [物质结构与性质]
一项科学研究成果表明,铜锰氧化物(CuMn2O4)能在常温下催化氧化空气中的一氧化碳和甲醛(HCHO)。
(1)向一定物质的量浓度的Cu(NO3)2和Mn(NO3)2溶液中加入Na2CO3溶液,所得沉淀经高温灼烧,可制得CuMn2O4。
①Mn2+基态的电子排布式可表示为?。
②NO3- 的空间构型是?(用文字描述)。
(2)在铜锰氧化物的催化下,CO 被氧化为CO2,HCHO 被氧化为CO2和H2O。
①根据等电子体原理,CO 分子的结构式为?。
②H2O 分子中O 原子轨道的杂化类型为?。
③1 mol CO2中含有的σ键数目为?。
(3) 向CuSO4溶液中加入过量NaOH 溶液可生成[Cu (OH)4 ]2-。不考虑空间构型,[Cu(OH)4]2-的结构可用示意图表示为?。
参考答案:
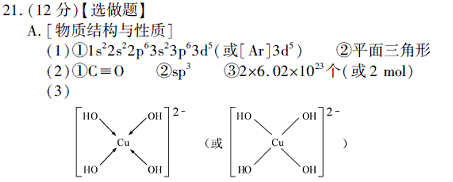
本题解析:(1)Mn原子序数为25,价电子排布为3d54s2,先失去4s上二个电子,即得Mn2+。NO3- 离子中氮原子无孤对电子,配位原子为3,则N采用sp2杂化,所以NO3- 的空间构型为平面三角形。(2)CO与N2互为等电子体,根据氮分子的结构式可以写出CO的结构式为C≡O。H2O中O原子存在两对孤对电子,配位原子为2,价电子对为4,所以O原子采用sp3杂化。二氧化碳分子内含有碳氧双键,双键中有一个为?键,一个为?键,则1molCO2中含有2mol?键。(3)Cu2+中存在空轨道,而OH-中O原子上面有孤对电子,故O与Cu之间以配位键结合。
【考点定位】电子排布式,空间构型,杂化方式,化学键的数法以及配位键的表示
本题难度:一般