微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 高锰酸钾溶液在酸性条件下可以与硫酸亚铁反应,化学方程式如下(未配平):
?KMnO4+?FeSO4+?H2SO4=?K2SO4+?MnSO4+ ?Fe2(SO4)3+?H2O
下列说法正确的是
A.MnO4-是氧化剂,Fe3+是还原产物
B.Fe2+的还原性强于Mn2+
C.取反应后的溶液加KSCN溶液,可观察到有血红色沉淀生成
D.生成1mol水时,转移2.5mol电子
参考答案:B
本题解析:A、MnO4-是氧化剂,Fe3+是氧化产物,错误;B、还原剂还原性强于还原产物,正确;C、KSCN溶液与Fe3+反应生成配离子溶液,不是沉淀,错误;
D、? 2 KMnO4+? 10 FeSO4+? 8 H2SO4=? 1 K2SO4+? 2 MnSO4+ ?5 Fe2(SO4)3+ 8?H2O(反应有10个电子转移)计算生成1mol水时,转移10÷8=1.25mol电子,错误。
本题难度:一般
2、选择题 某含铬Cr2O72- 废水用硫酸亚铁铵[FeSO4·(NH4)2 SO4·6H2O]处理,反应中铁元素和铬元素完全转化为沉淀。该沉淀干燥后得到n molFeO·FeyCrxO3(x、y可以是分数)。已知在该过程中铬元素转变成+3价,且不考虑处理过程中的实际损耗,下列叙述错误的是
A.处理的废水中含Cr2O72- 的物质的量为 mol
B.反应中发生转移的电子数为3nx mol
C.在FeO·FeyCrxO3中3x=y
D.消耗硫酸亚铁铵的物质的量为n(2x+1)mol
参考答案:D
本题解析:由铬元素守恒知废水中Cr2O72- 的物质量为mo,反应中发生转移的电子数为6×mo =3nx mol。由得失电子守恒知y=3x,而由铁元素守恒知消耗硫酸亚铁铵的物质量为n×(1+y)mol=n(3x+1)mol,因此选项D是错误的。
本题难度:一般
3、填空题 配平下列方程式:
(1)C+H2SO4(浓)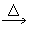 CO2↑+SO2↑+H2O______________________
CO2↑+SO2↑+H2O______________________
(2)Cu+ HNO3(稀)→Cu(NO3)2+NO↑+H2O______________________
(3)NH3+O2 NO+H2O______________________
NO+H2O______________________
参考答案:(1)C+2H2SO4(浓) CO2↑+2SO2↑+2H2O
CO2↑+2SO2↑+2H2O
(2)3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O
(3)4NH3+5O2 4NO+6H2O
4NO+6H2O
本题解析:
本题难度:一般
4、填空题 (14分)某实验小组分别用图1、2装置测定某种钙片中碳酸钙的含量,夹持装置已略去。提供的试剂:研细的钙片粉末 (钙片中的其他成分不与 盐酸反应)、
盐酸反应)、 盐酸、5%NaOH溶液、饱和
盐酸、5%NaOH溶液、饱和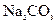 溶液、饱和
溶液、饱和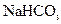 溶液和蒸馏水。
溶液和蒸馏水。
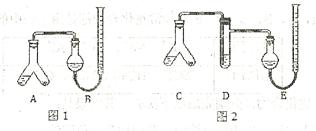 ?
?
实验过程:
Ⅰ.检查两套装置的气密性。
Ⅱ.在A、C的右边加入0.25g钙片粉末,左边加入3mL 盐酸,塞紧塞子。在B、E中均加入饱和
盐酸,塞紧塞子。在B、E中均加入饱和 溶液,如图所示,记下量气管读数。
溶液,如图所示,记下量气管读数。
Ⅲ.将A、C倾斜,使液体与固体混合,实验结束并冷却后读出量气管读数,测得B中收集到的气体为41.90mL,E中收集到的气体体积为39.20mL(以上气体体积均已折算为标准状况下的体积)。
回答下列问题:
(1)Ⅰ中检查图1装置气密性的方法是?
?。
(2)A中发生反应的离子方程式为?;
D中加入试剂为?,D的作用是?。
(3)实验前左右两管液 面在同一水平面上,最后读数时右管的液面高于左管的液面,应进行的操作是?
面在同一水平面上,最后读数时右管的液面高于左管的液面,应进行的操作是?
? ?。
?。
(4)图2实验所得钙片中的碳酸钙的质量分数为?;图1实验比图 2实验所得钙片中的碳酸钙含量偏高,用离子万程式表示偏高的原因?
?。
参考答案:
(1)往B中右侧量气管中加水,一段时间后量气装置左右液面差不变,说明气密性良好。
(2)CaCO3 + 2H+ = Ca2+ + CO2↑ + H2O?蒸馏水?吸收挥发出来的氯化氢
(3)向下移动右管,使左右两管液面相平。
(4)70%?HCO3- + H+ = CO2↑ + H2O?(每空2分)
本题解析:略
本题难度:一般
5、选择题 向50 mL稀H2SO4与稀HNO3的混合溶液中逐渐加入铁粉,假设加入铁粉的质量与产生气体的体积(标准状况)之间的关系如下图所示,且每一段只对应一个反应。下列说法正确的是(?)
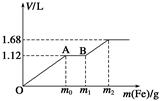
A.开始时产生的气体为H2
B.AB段产生的反应为置换反应
C.所用混合溶液中c(HNO3)=0.5 mol·L-1
D.参加反应铁粉的总质量m2=5.6 g
参考答案:D
本题解析:OA段:Fe+4H++NO3-=Fe3++NO↑+2H2O
AB段:2Fe3++Fe=3Fe2+
B以后:2H++Fe=H2↑+Fe2+
A项错,B项错。
C项,c(HNO3)=c(NO)= =1 mol·L-1,错误;
=1 mol·L-1,错误;
D项,由得失电子守恒得m(Fe)=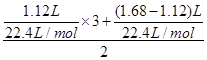 ×56=5.6 g,正确。
×56=5.6 g,正确。
本题难度:一般