微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (5分)A、B、C、D四种短周期元素,原子序数D>A>B>C,且A、B同周期,C、D同主族,A的原子结构示意图为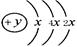 ;B、C可形成离子化合物B3C2,
;B、C可形成离子化合物B3C2,
据此利用相应的化学用语填空:
(1)A元素在周期表中的位置是?,其气态氢化物的化学式为?。
(2)A、B、C、D四种元素的原子半径由小到大的顺序为??。
(3)B和C最高价氧化物对应水化物的化学式分别为?和?。
参考答案:(1)第三周期 IVA; SiH4?(2)N<P<Si<Mg?(3)Mg(OH)2? HNO3
本题解析:K层只能容纳2个电子,即x=2,所以A的原子序数为14,即A是硅元素。A、B同周期,即都是第三周期。又因为B、C可形成离子化合物B3C2,所以B是Mg,C是N,则D是P。同主族自上而下原子半径逐渐增大,同周期自左向右原子半径逐渐减小,所以原子半径大小顺序为N<P<Si<Mg。
本题难度:简单
2、填空题 (21分)下表是元素周期表的一部分,回答有关问题。
?
| ?ⅠА
| ?ⅡА
| ?ⅢА
| ?ⅣА
| ?ⅤА
| ⅥА
| ?ⅦА
| ? 0
|
? 2
| ?
| ?
| ?
| ?
| ?①
| ?
| ?②
| ?
|
? 3
| ?③
| ?④
| ?⑤
| ?⑥
| ?
| ?⑦
| ?⑧
| ?⑨
|
? 4
| ?⑩
| ? 11
| ?
| ?
| ?
| ?
| ? 12
| ?
|
(1)在这些元素中,最活泼的金属元素是(均用元素名称填写)?—、最活泼的非金属元素是?、最不活泼的元素是?
(2)在这些元素的最高价氧化物对应的水化物中,酸性最强的是(均用化学式填写)?、碱性最强的是?,呈两性的氢氧化物是?,写出三者之间两两相互反应的离子方程式?
(3)在这些元素中,原子半径最大的是?—、原子半径最小的是?(均用元素符号填写)
(4)写出②与④形成化合物的电子式?;写出①单质的电子式?;
参考答案:(1)钾?氟?氩(每空1分)
(2)HClO4? KOH? Al(OH)3 ?
H+ + OH -= H2O? 3H+ + Al(OH)3 ?=? Al3+ + H2O?
OHˉ+ Al(OH)3 ?=? [Al(OH )4]ˉ(每空2分)
(3)? K? F (每空1分)
(4)氟化镁的电子式;氮气的电子式(每空2分)
本题解析:(1)题可以根据元素周期律,同周期从左到右元素金属性逐渐减弱,非金属性逐渐增强,同主族元素从上到下元素金属性逐渐增强,非金属性逐渐减弱,得出相应答案。
(2)题可以由最高价氧化物对应水化物的酸性和碱性强弱的判断依据,即非金属性越强酸性越强,金属性越强碱性越强。
(3)依据电子层数越多半径越大,电子层数相同时,原子序数越大半径越小得出答案。
(4)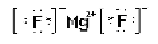 ?
?
本题难度:一般
3、推断题 A、B、C、D、E、F六种元素,其中A、B、C、D、E为短周期主族元素。它们之间的关系如下:
Ⅰ.原子半径:A < C < B < E< D?
Ⅱ.原子的最外层电子数:A = D? C= E? A + B = C
Ⅲ.原子的核外电子层数:B =" C" = 2A?
Ⅳ.B元素的主要化合价:最高正价 + 最低负价 = 2
请回答:
(1)甲为由A、B两种元素组成的常见气体,写出其电子式?;
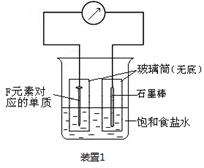
(2)写出某黑色含F的磁性氧化物与E最高价氧化物对应水化物的稀溶液反应的离子方程式:?。装置1经过一段时间向插入碳棒的玻璃筒内滴入酚酞溶液,可观察到碳棒附近的溶液变红,该电极反应为?。单质F发生?(填电化学腐蚀类型)
(3)向A、B、C三种元素组成的某盐稀溶液中滴加AgNO3溶液生成白色沉淀,该反应的化学方程式为?,已知该盐溶液常温下呈酸性,则0.1mol/L该盐溶液中离子浓度的大小顺序为?。
(4)上述元素中的五种元素可形成一种常见复盐,经检测该复盐中三种离子的个数比为2:1:2。则该复
盐的化学式为?。为检验该复盐中的某种有色离子存在,请写出实验的操作步骤和现象?
?。
参考答案:(共14分)(1)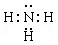 (1分)
(1分)
(2) Fe3O4+8H+=2Fe3++ Fe2++4H2O (2分);O2+2H2O+4e-=4OH- (2分) 吸氧腐蚀(1分)
(3) NH4NO2 + AgNO3=AgNO2↓+NH4NO3;c(NO2->c(NH4+)>c(H+)>c(OH-)(各2分)
(4)(NH4)2Fe(SO4)2、取少量该复盐于试管中并加水溶解,滴加KSCN溶液,无明显现象,再滴加新制氯水,溶液立即变红色,证明有Fe2+(或加氢氧化钠溶液,出现白色沉淀迅速变成灰绿色,最终变成红褐色。其他方案合理均可。)(各2分)
本题解析:A、B、C、D、E、F六种元素,其中A、B、C、D、E为短周期主族元素。根据原子的核外电子层数:B=C=2A可知,A为H元素,B、C为第二周期元素。原子的最外层电子数A=D,则D为Na元素。根据B元素的主要化合价:最高正价+最低负价=2可知。B为N元素。根据原子的最外层电子数:A+B=C可知,C为O元素。原子的最外层电子数:C=E可知,E为S元素。根据题中“某黑色含F的磁性氧化物”可知,F为Fe元素。
(1)A为H元素,B为N元素,甲为由A、B两种元素组成的常见气体,应为NH3。氨气是含有极性键的共价化合物,其电子式为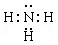 。
。
(2)黑色含F的磁性氧化物是四氧化三铁,其中Fe元素的化合价有+2价和+3价两种。E最高价氧化物对应水化物是硝酸,具有强氧化性,其稀溶液与四氧化三铁反应的离子方程式是Fe3O4+8H+=2Fe3++ Fe2++4H2O;根据装置1的构成可知,该装置是原电池,其中铁是负极,碳棒是正极。由于溶液是食盐水,所以发生的是钢铁的吸氧腐蚀,其中正极是氧气得到电子,其电极反应式是O2+2H2O+4e-=4OH-。
(3)A、B、C三种元素组成的盐为NH4NO2或NH4NO3,滴加AgNO3溶液生成白色沉淀,应为AgNO2沉淀,因为AgNO3溶于水,所以反应的化学方程式是NH4NO2 + AgNO3=AgNO2↓+NH4NO3;NH4NO2为强酸弱碱盐,水解呈酸性,所以溶液中离子浓度大小顺序为c(NO2->c(NH4+)>c(H+)>c(OH-)。
(4)复盐中三种离子的个数比为2:1:2,常见为(NH4)2Fe(SO4)2。其中有色离子是亚铁离子,亚铁离子具有还原性,其检验方法是取少量该复盐于试管中并加水溶解,滴加KSCN溶液,无明显现象,再滴加新制氯水,溶液立即变红色,证明有Fe2+(或加氢氧化钠溶液,出现白色沉淀迅速变成灰绿色,最终变成红褐色。或者滴加铁氰化钾溶液【K3[Fe(CN)6]】,立即有铁氰化亚铁的蓝色沉淀出现,反应式为:2Fe(CN)63-+Fe2+=Fe3[Fe(CN)6]2↓,证明有Fe2+。
本题难度:困难
4、选择题 钠与铯都是碱金属元素,下列关于铯及其化合物的叙述中不正确的是(?)
A.其单质在常温下与H2O的反应比Na更剧烈
B.其单质能从NaCl水溶液中置换出Na
C.CsOH属于强碱,其碱性强于NaOH
D.其单质极易被氧化,可保存在煤油中
参考答案:B
本题解析:铯与钠同属碱金属元素,化学性质相似,随着核电荷数增加和原子半径增大,铯比钠金属活动性更强,单质的还原性更强,单质更易被氧化,氢氧化物碱性也更强,A、C、D三项均正确。由于铯与水剧烈反应,生成氢氧化铯和氢气,它不能从NaCl溶液中置换出Na,B项错误。
本题难度:一般
5、选择题 短周期元素X、Y、Z中,X元素位于Y的前一周期,其原子最外电子层只有一个电子,Y原子的次外层电子数是最外层电子数的1/3;Z原子的最外层电子数与Y相同。下列X、Y、Z之间形成化合物的化学式不正确的是(? )
A.X2Z
B.ZY3
C.X2Y2
D.XZ2
参考答案:D
本题解析:本题考查元素在周期表中的位置,体现位置和结构之间的关系。由题意可知X元素为H,Y为O,Z为S。H2S、SO3、H2O2。D错误,不符合事实。
本题难度:简单