| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高考化学知识点整理《键参数——键能、键长与键角》考点强化练习(2017年押题版)(八)
?(请用相应的编号字母填写); 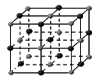 ? ? ? ? ? ? A?B?C?D?E (5)在冰晶体中,每个水分子与相邻的4个水分子形成氢键,已知冰的升华热是51 kJ/mol,除氢键外,水分子间还存在范德华力(11 kJ/mol),则冰晶体中氢键的“键能”是?kJ/mol; (6)将白色的无水CuSO4溶解于水中,溶液呈蓝色,是因为生成了一种呈蓝色的配合离子。请写出生成此配合离子的离子方程式:?。 参考答案:(1)1S22S22P4 (1分)?(2)H2S、NH2-(2分) (3)A (1分)?(4)BC (2分) 本题解析:(1)氧原子的核电荷数是8,根据构造原理可知外围电子有6个电子,2s能级上有2个电子,2p能级上有4个电子,所以水分子中氧原子在基态时核外电子排布式为1S22S22P4。 本题难度:困难 4、选择题 下列说法中不正确的是 参考答案:C 本题解析: 本题难度:简单 5、选择题 短周期元素X、Y、Z、W在元素周期表中的位置如下图所示,其中W为无机非金属材料的主角,下列说法正确的是( )
A.W位于第三周期IV族 B.Y的气态氢化物分子中含极性共价键 C.X的最高价氧化物的电子式是 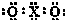 D.常温下不能用Z单质制成的容器盛放Y的最高价氧化物对应的水化物的浓溶液 参考答案:根据元素在周期表中的位置知,这四种元素处于第二、三周期,W为无机非金属材料的主角,是Si元素,根据这四种元素的位置得,Z是Al元素,x是C元素,Y是N元素. 本题解析: 本题难度:一般 |
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高中化学必备知识点《烃的衍生物.. | |