微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 能源问题是当前人类社会面临的一项重大课题,H2、CO、CH3OH都是重要的能源物质,它们的燃烧热依次为285.8 kJ/mol、282.5 kJ/mol、726.7 kJ/mol。
请回答:
(1)已知CO和H2在一定条件下可以合成甲醇:CO+2H2=CH3OH,则H2与CO反应生成CH3OH的热化学方程式为:________。
(2)下图为某种燃料电池的工作原理示意图,a、b均为惰性电极。
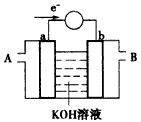
①使用时,空气从___口通入(填“A”或“B”);
②假设使用的“燃料”是甲醇,a 极的电极反应式为:_______________;
③假设使用的“燃料”是水煤气(成分为CO、H2),如用这种电池电镀铜,待镀金属增重6.4 g,则至少消耗标准状况下水煤气的体积为____________。
参考答案:(1)CO(g)+2H2(g)=CH3OH(l) △H=-127.4 kJ/mol
(2)①B;②CH3OH-6e-+8OH-=CO32-+6H2O;③2.24 L
本题解析:
本题难度:一般
2、选择题 有人设计出利用CH4和O2的反应,用铂电极在KOH溶液中构成原电池。电池的总反应类似于CH4在O2中燃烧,则下列说法正确的是
[? ]
①在标准状况下,每消耗5.6L?CH4可以向外电路提供2mole- ②通过甲烷电极的电极反应式为:CH4+10OH--8e-=CO32-+7H2O ③通过甲烷的电极为电池的正极,通过氧气的电极为负极 ④电池放电后,溶液pH不断升高
A.①②?
B.①③?
C.①④?
D.③④
参考答案:A
本题解析:
本题难度:一般
3、选择题 把A,B,C,D四块金属泡在稀H2SO4中,用导线两两相连可以组成各种原电池.若A,B相连A为负极;C,D相连D上有气泡逸出;A,C相连A?上发生氧化反应;B,D相连,B是电子流入的一极.则四种金属的活泼性顺序由大到小排列为( )
A.A>B>C>D
B.A>C>B>D
C.A>C>D>B
D.B>D>C>A
参考答案:原电池中,负极材料为较为活泼的金属,若A,B相连A为负极,所以A的活泼性大于B的活泼性;
C,D相连D上有气泡逸出,氢离子的正极上得电子发生还原反应生成氢气,所以C的活泼性大于D的活泼性;
A,C相连A?上发生氧化反应,负极材料为较为活泼的金属,发生氧化反应,所以A的活泼性大于C的活泼性;
B,D相连,B是电子流入的一极,电子从负极沿导线流向正极,所以D的活泼性大于B的活泼性;
所以则四种金属的活泼性顺序由大到小排列为A>C>D>B.
故选C.
本题解析:
本题难度:一般
4、填空题 研究碳及其化合物的综合利用对促进低碳社会的构建具有重要的意义。请运用相关知识研究碳及其化合物的性质。
(1)近年来,我国用电弧法合成的碳纳米管中常伴有大量碳纳米颗粒(杂质),这种碳纳米颗粒可用氧化气化法提纯,其反应的化学方程式为:
C+ K2Cr2O7+ — CO2↑+ K2SO4 + Cr2(SO4)3+ H2O
①完成并配平上述化学方程式。
②在上述方程式上用单线桥标出该反应电子转移的方向与数目。
(2)高温时,用CO还原MgSO4可制备高纯MgO。
①750℃时,测得气体中含等物质的量SO2和SO3,此时反应的化学方程式是 。
②由MgO可制成“镁-次氯酸盐”电池,其装置示意图如图1,该电池反应的离子方程式为 。
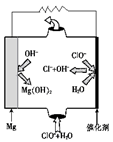

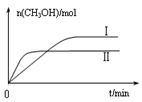
图1 图2 图3
(3)二氧化碳合成甲醇是碳减排的新方向,将CO2转化为甲醇的热化学方程式为:CO2(g) +3H2(g) CH3OH(g) +H2O(g) △H
CH3OH(g) +H2O(g) △H
①该反应的平衡常数表达式为K= 。
②取五份等体积CO2和H2的混合气体(物质的量之比均为1∶3),分别加入温度不同、容积相同的恒容密闭容器中,发生上述反应,反应相同时间后,测得甲醇的体积分数φ(CH3OH)与反应温度T的关系曲线如图2所示,则上述CO2转化为甲醇反应的△H 0(填“>”“<”或“=”)。
③在两种不同条件下发生反应,测得CH3OH的物质的量随时间变化如图3所示,曲线I、II对应的平衡常数大小关系为KⅠ KII(填“>” “<”或“=”)。
参考答案:(1)①3 2 8 H2SO4 3 2 2 8 (2分)
②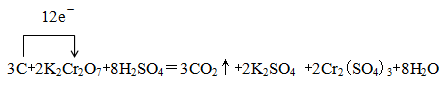 (1分)
(1分)
(2)①2MgSO4 + CO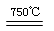 2MgO + SO2 + CO2 + SO3(3分)
2MgO + SO2 + CO2 + SO3(3分)
②Mg + ClO- + H2O=Cl- + Mg(OH)2(3分)
(3)①K=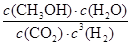 (2分) ②< (2分) ③> (2分)
(2分) ②< (2分) ③> (2分)
本题解析:(1)①根据反应式可知,反应中碳元素的化合价从0价升高到+4价,失去4个电子,碳是还原剂。Cr元素的化合价从+6价降低到+3价,得到3个电子,K2Cr2O7是氧化剂。根据电子得失守恒可知,还原剂碳与氧化剂K2Cr2O7的物质的量之比是3:2。根据原子守恒可知,反应前还有硫酸参加,因此配平后的方程式为3C+2K2Cr2O7+8H2SO4=3CO2↑+2K2SO4 +2Cr2(SO4)3+8H2O。
②根据①可知,用单线桥标出该反应电子转移的方向与数目为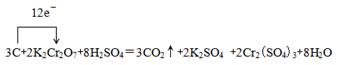 。
。
(2)①用CO还原MgSO4,在750℃时,测得气体中含等物质的量SO2和SO3,其中S元素的化合价从+6价降低到+4价,得到2个电子,所以根据电子得失守恒可知,CO的氧化产物是CO2,且与SO2的物质的量相等,因此此时反应的化学方程式是2MgSO4 + CO 2MgO + SO2 + CO2 + SO3。
2MgO + SO2 + CO2 + SO3。
②根据图1可知,镁是负极失去电子转化为氢氧化镁。次氯酸盐在正极得到电子,被还原为氯离子,所以该电池的总反应离子方程式为Mg + ClO- + H2O=Cl- + Mg(OH)2。
(3)①化学平衡常数是在一定条件下,当可逆反应达到平衡状态时,生成物浓度的幂之积和反应物浓度的幂之积的比值,所以根据方程式可知该反应的平衡常数表达式为K=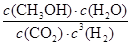 。
。
②根据图2可知,在甲醇的含量达到最大值后,如果升高温度,甲醇的含量反而降低,这说明升高温度平衡向逆反应方向移动,因此正方应是放热反应,即△H<0。
③根据图3可知,曲线Ⅱ首先达到平衡状态,这说明曲线Ⅱ的反应速率快。但曲线Ⅱ对应的甲醇物质的量小于曲线I对应的甲醇的物质的量。由于该反应是体积减小的放热的可逆反应,所以反应条件应该是升高温度,促使平衡向逆反应方向移动,因此平衡常数减小,即KⅠ>KII。
考点:考查氧化还原反应配平、表示;原电池判断;平衡常数以及外界条件对平衡状态的影响
本题难度:困难
5、选择题 如图装置中,在U形管底部盛有 ,分别在U形管两端小心倒入饱和食盐水和饱和稀硫酸溶液,并使a、b两处液面相平,然后分别塞上插有生铁丝的塞子,密封好,放置一段时间后,下列有关叙述错误的是
,分别在U形管两端小心倒入饱和食盐水和饱和稀硫酸溶液,并使a、b两处液面相平,然后分别塞上插有生铁丝的塞子,密封好,放置一段时间后,下列有关叙述错误的是
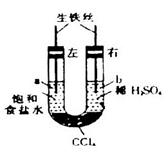
A.铁丝在两处的腐蚀速率: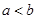
B.a、b两处相同的电极反应式为
C.一段时间后,a处液面高于b处液面
D.生铁丝中的碳在a、b两处分别作原电池的负极和正极
参考答案:D
本题解析:生铁和氯化钠溶液、稀硫酸溶液都能构成原电池,左边试管中,生铁发生吸氧腐蚀,右边试管中,生铁发生析氢腐蚀。A、生铁发生析氢腐蚀的速率比吸氧腐蚀的速率大,正确;B、a处负极上铁失电子,正极上氧气得电子,b处负极上铁失电子,正极上氢离子得电子,所以a、b两处相同的电极反应式为Fe-2e-=Fe2+,正确;C、a处发生吸氧腐蚀,b处发生析氢腐蚀,一段时间后,a处气体压强减小,b处气体压强增大,导致溶液从b处向a处移动,所以a处液面高于b处液面,正确;D、生铁中的碳在a、b两处都作正极,错误。
本题难度:一般