微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 对下列实验现象的解释不正确的是
A.①
B.②
C.③
D.④
参考答案:A
本题解析:分析:①根据C12无漂白性,HClO具有漂白性;
②根据烟是固体小颗粒;
③根据钠能被氧气氧化;
④根据氢氧化铝具有两性;
解答:①因C12无漂白性,但遇到鲜艳的红色,因花中含有水,能与水反应:C12+H2O?HCl+HClO,HClO具有漂白性,所以花瓣褪色,故①错误;
②因NH3与HCl气体接触时发生反应:NH3+HCl=NH4Cl,NH4Cl是固体,所以有白烟产生,故②正确;
③因Na容易与空气中的氧气氧化:4Na+2O2=2Na2O,新切开的Na表面在空气中很快变暗,故③正确;
④氯化铝溶液中滴入氢氧化钠溶液,发生反应:A1Cl3+3NaOH═A1(OH)3↓+3NaCl,继续滴入氢氧化钠溶液,由于
氢氧化铝具有两性,能与氢氧化钠反应:A1(OH)3+NaOH═NaAlO2+2H2O,白色沉淀溶解.故④正确;
故选:A.
点评:本题主要考查了元素及其化合物的有关知识,难度不大,根据课本知识即可完成.
本题难度:困难
2、选择题 已知98%的浓硫酸的浓度为18.4mol.L-1,则49%的硫酸溶液的浓度为(硫酸溶液的浓度越大时,其溶液的密度越大)
A.9.2mol.L-1
B.大于9.2mol.L-1
C.小于9.2mol.L-1
D.无法确定
参考答案:C
本题解析:分析:根据c=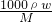 及硫酸溶液的浓度越大时,其溶液的密度越大来分析.
及硫酸溶液的浓度越大时,其溶液的密度越大来分析.
解答:设49%的硫酸溶液的浓度为为c,98%的浓硫酸的密度为ρ1,49%的硫酸溶液的密度为ρ2,
则18.4mol/L=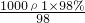 ,
,
c=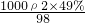 ,
,
由硫酸溶液的浓度越大时,其溶液的密度越大,
则ρ1>ρ2,
所以c<9.2mol.L-1,
故选C.
点评:本题考查物质的量浓度的计算,明确质量分数与物质的量浓度的关系是解答本题的关键,并注意密度与浓度的关系来解答,难度不大.
本题难度:困难
3、选择题 借助于化学方法,分子是可以再分的,而原子不能用化学方法再分为更小的微粒。下列实验事实最能体现上述论点的是
A.食盐固体溶于水消失
B.盛浓盐酸的试剂瓶打开冒白雾
C.干冰露置在空气中逐渐消失
D.红色氧化汞粉末受热分解成氧气和汞
参考答案:D
本题解析:试题分析:此题主要考查物质的化学变化。答题时,需充分理解题意。题干中给出的信息“分
子是可以再分的,而原子不能用化学方法再分为更小的微粒”实际上就说出了化学变化的实质。所以,对四个选项的分析,首先应从“物理变化”、“化学变化”入手。
对于A选项,食盐溶于水,应属于物理变化;
对于B选项,浓盐酸冒白烟,主要体现的是浓盐酸的挥发性,挥发性属于物理性质,因此,B选项所描述的也是一种物理变化;
对于C选项,干冰在空气中逐渐消失,是干冰的升华现象,也属于物理变化;
对于D选项,氧化汞受热分解,则是一种化学变化。在这一过程中,氧化汞受热分解为汞原子和氧原子,而这两种原子不可再分为更小的粒子,重新结合形成新的物质,即氧气和汞单质。
考点:化学变化的实质;物理变化;化学变化
点评:1、本题主要考查化学变化的实质:“在化学变化中,分子断裂成为原子,原子重新
组合,形成新的分子。”
2、区别物理变化与化学变化的根本在于是否有新物质生成,有新物质生成的变化则为化学变化,否则为物理变化。另外,区分化学变化与物理变化也可以从描述所体现的性质入手,体现物理性质的则为物理变化;体现化学性质的则为化学变化。
本题难度:困难
4、选择题 用NA代表阿伏加德罗常数,下列说法正确的是?
A.标准状况下,22.4 L CHCl3中含有的氯原子数目为3NA
B.7 g CnH2n中含有的氢原子数目为NA
C.18 g D2O中含有的质子数目为10NA
D.1 L 0.5 mol/L Na2CO3溶液中含有的CO32-数目为0.5NA
参考答案:B
本题解析:试题分析:本题主要考查“阿伏伽德罗常数”的相关应用,是高考中必考的内容,考生在复习时应有意识的加强此类题目的训练。
选项A、标准状态下,CHCl3为液态,因此不可以用气体摩尔体积计算。
选项B、正确。7 g CnH2n的物质的量为
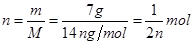 ;因此氢原子的个数
;因此氢原子的个数
为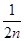 ?×2n=1mol,因此其氢原子数目为NA。
?×2n=1mol,因此其氢原子数目为NA。
选项C、18 g D2O的物质的量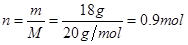 。因此所含的质子数应
。因此所含的质子数应
为0.9mol×10=9mol,为9NA。
选项D、1 L 0.5 mol/L Na2CO3溶液中,n(Na2CO3)="1" L×0.5 mol/L="0.5" mol,应为0.5NA,但是,此时应考虑到CO32-在水中会发生水解,因此CO32-的数目应该小于0.5NA。
考点:阿伏伽德罗常数
点评:本题虽是对阿伏伽德罗定律的考查,但是涉及到的知识点较为全面。解题时应综合各部分的知识点
1. ?
?
2.N=c·V
本题难度:简单
5、选择题 下列说法正确的是
A.在标准状况下,1mol水的体积是22.4L
B.1molH2所占的体积约为22.4L
C.在标准状况下,NA个分子所占的体积约为22.4L
D.在标准状况下,1molNH3和CO混合气体所占的体积约为22.4L
参考答案:D
本题解析:分析:A根据气体摩尔体积的使用范围判断;
B根据气体摩尔体积的使用条件判断;
C、根据气体摩尔体积的使用范围判断;
D根据气体摩尔体积的定义判断.
解答:A、气体摩尔体积的使用范围是气体,水是液体,故A错误.
B、在标况下,1molH2所占的体积约为22.4L,没有前提条件,故B错误.
C、未注明该物质的状态,不能确定其体积,故C错误.
D、在标准状况下,1mol任何气体所占的体积约为22.4L,任何气体既值纯净物又指混合物,故D正确.
故选:D
点评:本题考查的是气体摩尔体积,注意气体摩尔体积的使用范围、条件,正确理解定义中“任何”的含义.
本题难度:一般