微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 NA表示阿伏加德罗常数的值,下列说法中正确的是
A.1.8g重水(D2O)中含有的质子数和电子数均为1.ONA
B.500℃、30MPa下,△H=-38.6?kJ?mol-1.将分子数为1.5NA的H2和过量N2在此条件下充分反应,放出热量19.3kJ
C.标准状况下,将11.2?LCl2通入足量的石灰乳中制备漂白粉,转移的电子数为0.5NA
D.15g石英晶体中含有的Si-O键数目为2NA
参考答案:C
本题解析:分析:A.1mol重水(D2O)中含有的质子数和电子数均为1ONA;
B.反应热表示该反应完全进行到底时的热效应;
C.氯气和石灰乳反应是氯气自身氧化还原反应,化合价从0价变化为-1价和+1价;
D.1mol二氧化硅中含4mol硅氧键.
解答:A.1.8g重水物质的量为 =0.09mol,含有的质子数和电子数均为9NA,故A错误;
=0.09mol,含有的质子数和电子数均为9NA,故A错误;
B.由于1.5mol氢气在合成氨反应中不可能完全转化,因此放出的热量必小于19.3kJ,故B错误;
C.标准状况下,11.2 L Cl2物质的量为0.5mol,通入足量的石灰乳中制备漂白粉,转移的电子数为0.5NA,故C正确;
D.15g石英晶体屋子里的为0.25mol,结构中含有的Si-O键数目为NA,故D错误.
故选C.
点评:本题考查阿伏加德罗常数,题目难度不大,注意从物质的组成、结构、性质、聚集状态以及存在的条件是否标准状况等角度思考.
本题难度:困难
2、选择题 等质量的下列物质中,所含分子数最少的是
A.Cl2
B.HCl
C.Br2
D.HBr
参考答案:C
本题解析:分析:根据n=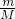 =
= 计算,物质的物质的量越小,分子数越小.
计算,物质的物质的量越小,分子数越小.
解答:假设质量都为mg,则
A.N(Cl2)=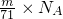 ;
;
B.N(HCl)= ;
;
C.N(Br2)=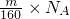 ;
;
D.N(HBr)= ,
,
则所含分子数最少的是Br2,
故选C.
点评:本题考查物质的量的计算,本题也可根据n=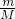 =
= 直接得出分子数与摩尔质量的关系进行判断.
直接得出分子数与摩尔质量的关系进行判断.
本题难度:困难
3、选择题 用NA表示阿伏加德罗常数的值.下列说法正确的是
A.标准状况下,22.4?L?H2O中含有的分子数为NA
B.28?g?N2中含有的分子数为NA
C.1?mol?Mg与足量稀盐酸反应转移的电子数为NA
D.1?L?1?mol?L-1?Na2?CO3溶液中含有的钠离子数为NA
参考答案:B
本题解析:分析:A、标准状况下,水是液体,无法求算物质的量;
B、28g氮气的物质的量是1mol,含有分子数是NA;
C、1mol镁反应失去2mol电子;
D、碳酸钠的物质的量是1mol,含有2mol钠.
解答:A、由于标况下,水不是气体,故无法计算其物质的量,故A错误;
B、氮气的摩尔质量是28g/mol,28g氮气的物质的量是1mol,含有的分子数为NA,故B正确;
C、1mol镁与足量盐酸反应,失去1mol电子,转移的电子数为2NA,故C错误;
D、该碳酸钠溶液中含有1mol碳酸钠,含有2mol钠离子,故含有的钠离子数为2NA,故D错误;
故选B.
点评:本题借助阿伏伽德罗常数,考查了有关物质的量的简单计算,注意物质的状态,本题难度中等.
本题难度:一般
4、选择题 2011年为国际化学年,主题为“化学-我们的生活,我们的未来”.?下列说法错误的是
A.化学是一门以实验为基础的自然科学
B.化学是在原子、分子水平上研究物质的科学
C.绿色化学的核心是应用化学原理对环境污染进行治理
D.化学是生命科学、材料科学、能源科学等的重要基础
参考答案:C
本题解析:分析:根据化学的特点解题,绿色化学的核心是:利用化学原理从源头上减少和消除工业生产对环境的污染.
解答:A.化学是一门以实验为基础的自然科学,故A正确.
B.化学是在原子、分子水平上研究物质的科学,故B正确.
C.绿色化学的核心是:利用化学原理从源头上减少和消除工业生产对环境的污染.故C错误.
D.化学是生命科学、材料科学、能源科学等的重要基础,故D正确.
故选C.
点评:了解化学探究的领域,明了化学学习的意义,为学生学好化学,树立为化学科学奋斗的目标,激励学生的社会责任感都有重要的意义.
本题难度:一般
5、选择题 NA表示阿伏伽德罗常数,下列叙述正确的是
A.1?mol?Cu和足量浓硝酸反应可收集NO2的分子数为2?NA
B.4℃时,3.6?mL?水所含的电子数为2?NA
C.30.8?g熟石膏(2CaSO4?H2O)中的钙离子数目为0.20?NA
D.200?mL?0.5?mol?L-1的Na2CO3溶液中阴离子数目小于0.1?NA
参考答案:B
本题解析:分析:A、1 mol Cu和足量浓硝酸反应可生成2molNO2,但是由于NO2和N2O4之间有一个平衡:2NO2?N2O4,所以分子数小于2NA;
B、依据水的密度可知水的质量,可求出水的物质的量,再根据水中电子数计算;
C、依据熟石膏的质量求出其物质的量,再求出Ca2+;
D、由于CO32-要发生水解,其水解方程为:CO32-+H2O?HCO3-+OH-,根据水解方程可知阴离子数目增加.
解答:A、1 mol Cu和足量浓硝酸反应可生成2molNO2,但是由于NO2和N2O4之间有一个平衡:2NO2?N2O4,所以分子数小于2NA,故A错误;
B、依据水的密度可知水的质量m(水)=3.6g,则水的物质的量为n(水)= =
=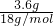 =0.2mol,又因为一个水分子中含有10个电子,故电子的物质的量为2mol,故电子数为2 NA,故B正确;
=0.2mol,又因为一个水分子中含有10个电子,故电子的物质的量为2mol,故电子数为2 NA,故B正确;
C、依据熟石膏的质量求出其物质的量n= =
= =0.106mol,所以n(Ca2+)=0.212,故C错误;
=0.106mol,所以n(Ca2+)=0.212,故C错误;
D、由于CO32-要发生水解,其水解方程为:CO32-+H2O?HCO3-+OH-,根据水解方程可知阴离子数目增加,故阴离子数目大于0.1 NA,故D错误;
故选B.
点评:本题考查了阿伏伽德罗常数的应用,主要是物质中微粒数目的求算,要注意考虑盐类水解;题目难度中等.
本题难度:简单