微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 某同学欲配制0.1 mol/LBa(OH)2溶液,但只找到在空气中暴露已久的Ba(OH)2试剂。配制溶液时发现所取试剂在水中仅部分溶解,烧杯中存在大量未溶物。
(1)他猜测烧杯中未溶物为BaCO3。理由是_____________;检验方法是_______________。
(2)为准确测定样品中Ba(OH)2的含量。进行如下实验:
①配制250 mL约0.1 mol/L Ba(OH)2溶液:称取5.000 g试样,置于烧杯中,加适量蒸馏水,充分搅拌溶解,静置过滤,得滤液和沉淀,将滤液转入______中,洗涤,定容,摇匀。
②滴定:准确量取25.00 mL所配制Ba(OH)2溶液于锥形瓶中,滴加2滴甲基橙,将0.200 mol/L标准盐酸装入滴定管,滴定至终点,记录数据。重复滴定2次。平均消耗盐24.20 mL。计算样品中Ba(OH)2的质量分数为____________。
(3)上述滴定中,滴定管在注入标准盐酸之前,先用蒸馏水洗净,再用________________。在滴定中,准确读数应该是滴定管上蓝线的________________处所对应的刻度。滴定终点的现象是_______________。
参考答案:(1)Ba(OH)2能与空气中的CO2反应,生成难溶于水的BaCO3;取适量沉淀于试管中,滴加稀盐酸,若有无色无味的气体产生,且产生的气体能使澄清石灰水变混浊,说明该试剂中含有BaCO3(2分)。
(2)①250 mL容量瓶中。②0.82764(或0.83)(2分)。
(3)标准盐酸溶液润洗2~3次,粗细交界点。溶液由黄色变为橙色,且半分钟内保持不变。
本题解析:(1)氢氧化钡溶液与空气中的二氧化碳反应生成碳酸钡沉淀和水,化学方程式为:
CO2+Ba(OH)2=BaCO3↓+H2O;沉淀中若含有碳酸钡,加入盐酸,碳酸钡与盐酸反应产生二氧化碳,会看到有气泡产生。
(2)①配制250 mL约0.1 mol/L Ba(OH)2溶液要用250 mL容量瓶。
②0.82764(或0.83)(2分)。
Ba(OH)2?~? 2HCl
1mol? 2mol
25.00 mL×cmol/L? 0.200 mol/L×24.20mL
Ba(OH)2 浓度0.0968mol/L? Ba(OH)2的质量0.0968mol/L×0.250 L×171g/mol =4.1382g
中Ba(OH)2的质量分数为4.1382÷5×100%=0.82764(或0.83)
(3)滴定管要用标准液润洗2~3次,准确读数应该是滴定管上蓝线粗细交界点,溶液由黄色变为橙色,且半分钟内保持不变。
本题难度:一般
2、选择题 下列实验能获得成功的是
A.苯和浓溴水混合加入铁做催化剂制溴苯
B.除去乙烷中的乙烯,将混合气体通过盛有酸性KMnO4溶液的洗瓶
C.向蔗糖水解后的液体中加入新制Cu(OH)2悬浊液,加热到沸腾,验证水解产物为葡萄糖
D.乙烯通入溴的四氯化碳溶液中获得l,2-二溴乙烷
参考答案:D
本题解析:
专题:有机物的化学性质及推断.
分析:A、苯和溴水不反应,在催化剂作用下,苯和液溴能反应.
B、从乙烯与酸性高锰酸钾溶液的反应产物来分析;
C、根据银镜反应的酸碱性环境分析;
D、根据乙烯的性质反应;
解答:A、苯和溴水不反应,在铁作催化剂条件下,苯和液溴能发生取代反应制取溴苯,故A错误.B、乙烯被酸性高锰酸钾氧化为二氧化碳,不能得到纯净的乙烷,应通入溴水中除去杂质,故B错误;C、蔗糖是在酸性条件下水解,所以水解后溶液呈酸性;银镜反应实验是在碱性条件下进行,所以要做银镜反应实验,必须先中和酸,使溶液呈碱性,然后再做该实验,故C错误.
D、乙烯能和溴发生加成反应,所以乙烯通入溴的四氯化碳溶液中获得l,2-二溴乙烷,故D正确。故选D。
点评:本题考查了乙烯、苯的化学性质,难度不大,注意乙烯能使溴、高锰酸钾溶液褪色,但褪色原理不同,一个是加成反应,一个是氧化还原反应。
本题难度:一般
3、选择题 下列黄色不属于因为化学反应而产生的现象的是?
A.无色试剂瓶中的浓硝酸呈黄色
B.久置的KI溶液呈黄色
C.鸡蛋白遇浓硝酸呈黄色
D.在普通玻璃导管口点燃纯净氢气时,火焰呈黄色
参考答案:D
本题解析:A、因为硝酸分解生成了NO2,溶解在其中,显黄色;
B、碘离子氧化为碘单质,显黄色;
C、蛋白质的性质;
D、是钠元素的焰色反应,是原子内部变化,不属于化学反应。
本题难度:简单
4、选择题 下列实验操作正确的是:
A.排水法收集气体后,先熄灭酒精灯,再取出导气管
B.蒸馏自来水时,冷凝水从下口进,从上口出
C.用试管取出试剂瓶中的Na2CO3溶液,发现取量过多,为了不浪费,又把过量的试剂倒入试剂瓶中
D.稀释浓硫酸时,应将水慢慢加入浓硫酸中并及时搅拌
参考答案:B
本题解析:A不正确,应该是先取出导气管,后熄灭酒精灯,以防止液体倒流;为防止试剂的污染,过量的试剂不能放回原试剂瓶中,C不正确;浓硫酸溶于水放出大量的热,且浓硫酸的密度大于水的,所以稀释浓硫酸时应该将浓硫酸沿着器壁注入水中,同时用玻璃棒不断的搅拌,D不正确,答案选B。
本题难度:简单
5、实验题 以下是分析硫铁矿中FeS2含量的三种方法,各方法的操作流程图如下:
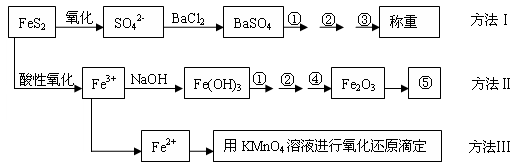
请回答下列问题:
(1)流程图中操作①、②、③分别指的是①_________、②__________、③________。
操作④、⑤用到的主要仪器是:④__________、⑤__________(每空填1-2个仪器)。
(2)判断溶液中SO42-离子已沉淀完全的方法是_________________________________。
(3)某同学用方法Ⅲ测定试样中Fe元素的含量,准确称取一定量的矿石试样,试样经溶解、预处理后,
A.用带有刻度的烧杯配制成100 mL试样溶液。
B.用量筒量取25.00 mL待测溶液,
C.并置于锥形瓶中。
D.用蒸馏水洗涤滴定管后装入KMnO4标准溶液,用该标准溶液滴定待测试样,(E)当溶液变成淡紫红色时,停止滴定,如30秒内不褪色,(F)读取并计算滴定管中消耗的KMnO4标准溶液体积,计算试样中的Fe元素含量。请指出该实验过程中错误操作步骤的编号________________________。