微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 将AgCl与AgBr的饱和溶液等体积混合,再加入足量浓AgNO3溶液,发生的反应为
[? ]
A.只有AgBr沉淀生成
B.AgCl和AgBr沉淀等量生成
C.AgCl和AgBr沉淀都有,但以AgCl沉 淀为主
D.AgCl和AgBr沉淀都有,但以AgBr沉淀为主
参考答案:C
本题解析:
本题难度:一般
2、选择题 某温度时,AgCl在水中的沉淀溶解平衡曲线如图所示。下列说法正确的是
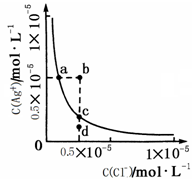
A.加入NaCl可以使溶液由a点变到b点
B.向AgCl饱和溶液中加入水, C(Ag+)增大
C.d点无AgCl沉淀生成
D.a点对应的Ksp大于c点对应的Ksp
参考答案:C
本题解析:,AgCl在水中的沉淀溶解平衡方程式为: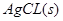 ?
?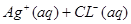 ,所以
,所以
A错,加入NaCl,溶液中氯离子浓度增大,沉淀溶解平衡向逆反应方向移动,溶液中的银离子浓度减小;B错,饱和溶液中加入水,此时仍然是饱和溶液,溶液中各离子浓度不变;C正确;溶液中浓度积小于溶度积,处于不饱和状态;D错,溶度积受温度影响与其他因素无关;
本题难度:一般
3、选择题 在t ℃时,AgBr在水中的沉淀溶解平衡曲线如图所示。又知t ℃时AgCl的Ksp=4×10-10,下列说法不正确的是

A.在t ℃时,AgBr的Ksp为4.9×10-13
B.在AgBr饱和溶液中加入NaBr固体,可使溶液由c点变到b点
C.图中a点对应的是AgBr的不饱和溶液
D.在t ℃时,AgCl(s)+Br-(aq) AgBr(s)+Cl-(aq)平衡常数K≈816
AgBr(s)+Cl-(aq)平衡常数K≈816
参考答案:D
本题解析:根据图中c点的c(Ag+)和c(Br-)可得该温度下AgBr的Ksp为 Ksp=4.9×10-13,A正确。在AgBr饱和溶液中加入NaBr固体后,c(Br-)增大,溶解平衡逆向移动,c(Ag+)减小,故B错。在a点时Qc< Ksp,故B错。故为AgBr的不饱和溶液,C正确。选项D中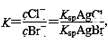 ,代入数据得,K≈816,D正确。
,代入数据得,K≈816,D正确。
本题难度:一般
4、简答题 常温下:Ksp〔Mg(OH)2〕=1.2×10-11mol3?L-3 Ksp(AgCl)=1.8×10-10mol2?L-2Ksp(Ag2CrO4)=1.9×10-12mol3?L-3,
Ksp(CH3COOAg)=2.3×10-3mol2?L-2下列叙述正确的是( )
A.等体积混合浓度均为0.2?mol?L-1的AgNO3溶液和CH3COONa溶液一定产生CH3COOAg沉淀
B.将0.001?mol?L-1的AgNO3溶液滴入0.001?mol?L-1的KCl和0.001?mol?L-1的K2CrO4溶液中先产生Ag2CrO4沉淀
C.在Mg2+为0.121?mol?L-1的溶液中要产生Mg(OH)2沉淀,溶液的pH至少要控制在9以下
D.向饱和AgCl水溶液中加入NaCl溶液,Ksp(AgCl)变大
参考答案:A.等体积混合浓度均为0.1mol?L-1,c(CH3COO-)×c(Ag+)=0.01>2.3×10-3,一定产生CH3COOAg沉淀,故A正确;
B.将0.001 mol?L-1的AgNO3溶液滴入0.001 mol?L-1的KCl和0.001 mol?L-1的K2CrO4溶液中,c(Ag+)×c(Cl-)=10-6,c2(Ag+)×c(CrO42-)=10-9,AgCl先达到饱和,应先生成AgCl沉淀,故B错误;
C.Ksp〔Mg(OH)2〕=c(Mg2+)×c2(OH-),c(OH-)≥
本题解析:
本题难度:一般
5、选择题 下列实验操作与预期实验目的或所得实验结论一致的是
选项
| 实验操作
| 实验目的或结论
|
A
| 某钾盐溶于盐酸,产生能使澄清石灰水变浑浊的无色无味气体
| 说明该钾盐是K2CO3
|
B
| 向含有少量FeCl3的MgCl2溶液中加入足量Mg(OH)2粉末,搅拌一段时间后过滤
| 除去MgCl2溶液中少量FeCl3
|
C
| 常温下,向饱和Na2CO3溶液中加少量BaSO4粉末,过滤,向洗净的沉淀中加稀盐酸,有气泡产生
| 说明常温下Ksp(BaCO3)<Ksp(BaSO4)
|
D
| C2H5OH与浓硫酸170 ℃共热,制得的气体通入酸性KMnO4溶液
| 检验制得气体是否为乙烯
|
参考答案:B
本题解析:A、某钾盐溶于盐酸,产生能使澄清石灰水变浑浊的无色无味气体,该钾盐可能含CO32-、HCO3-,故A错误;B、向含有少量FeCl3的MgCl2溶液中加入足量Mg(OH)2粉末,搅拌一段时间后过滤,Fe3+发生水解反应:Fe3++3H2O?Fe(OH)3+3H+,足量Mg(OH)2消耗H+促进Fe3+水解,使Fe3+完全水解成Fe(OH)3过滤除去,故B正确;C、常温下,向饱和Na2CO3溶液中加少量BaSO4粉末,部分BaSO4因饱和Na2CO3溶液中高浓CO32-转化BaCO3,因此向洗净的沉淀中加稀盐酸,有气泡产生,但是Ksp(BaCO3)>Ksp(BaSO4),故C错误;D、C2H5OH与制得的乙烯都有还原性,通入酸性KMnO4溶液都会褪色,故D错误。
考点:本题考查实验方案的设计与分析。
本题难度:一般