微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列现象或事实可用同一原理解释的是( )
A.氯水和SO2使品红溶液褪色
B.乙炔和乙烯使溴的四氯化碳溶液褪色
C.浓硝酸和浓盐酸长期暴露在有光照的空气中浓度降低
D.过氧化钠和水玻璃长期暴露在空气中最后均变质失效
参考答案:A、氯水中含有次氯酸,具有强氧化性,使品红褪色,不能复原,SO2与品红发生化合使品红褪色,加热能复原,二者褪色原理不同,故A错误;
B、乙烯和乙炔都含有不饱和键,与溴发生加成反应而使溴水褪色,原理相同,故B正确;
C、硝酸的不稳定,在光照条件下能分解,属于化学变化,盐酸易挥发,属于物理变化,二者浓度变小原理不同,故C错误;
D、过氧化钠与空气中二氧化碳发生氧化还原反应,硅酸比碳酸弱,水玻璃长期暴露在空气中最后生成硅酸,二者原理不同,故D错误.
故选B.
本题解析:
本题难度:一般
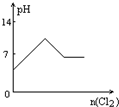
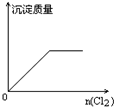
2、选择题 向H2S的水溶液中通入一定量的Cl2,下列图象所示的变化正确的是( )
A.
B.

C.
D.
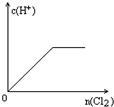
参考答案:H2S与Cl2发生反应:H2S+Cl2=2HCl+S↓,则
A.H2S为弱电解质,HCl为强电解质,溶液pH逐渐减小,故A错误;
B.H2S为弱电解质,HCl为强电解质,溶液离子浓度逐渐增大,故B错误;
C.生成S沉淀,当H2S反应完时,沉淀的量不变,故C正确;
D.开始时为H2S溶液,C(H+)>0,溶液呈酸性,故D错误.
故选C.
本题解析:
本题难度:简单
3、填空题 1984年,地坛医院的前身北京第一传染病医院研制成功能迅速杀灭各类肝炎病毒的消毒液,经北京市卫生局组织专家鉴定,授予应用成果 二等奖,定名为“84”肝炎洗消液,后更名为“84消毒液”。
二等奖,定名为“84”肝炎洗消液,后更名为“84消毒液”。
(1) “84消毒液”的有效成分是NaClO。其工业制法是利用Cl2与NaOH反应得到,请写出该反应的化 学反应方程式_______________________;另外,电解NaCl溶液可直接制备84消毒液,通电时氯气被溶液完全吸收,请写出电解NaCl溶液的化学反应方程式___________。
学反应方程式_______________________;另外,电解NaCl溶液可直接制备84消毒液,通电时氯气被溶液完全吸收,请写出电解NaCl溶液的化学反应方程式___________。
(2)“84消毒液”可用于公共场所卫生洁具清理和染 色白毛巾的处理,但不宜与其他洗涤液混用,尤其不能与洁厕灵混合,混合后容易发生的离子反应方程式是
色白毛巾的处理,但不宜与其他洗涤液混用,尤其不能与洁厕灵混合,混合后容易发生的离子反应方程式是
___________________________。
(3)“84消毒液”本品在空气中露置一段时间会失效,试解释失效的主要原因
__ _________________
_________________ ___________________________________
___________________________________ ______________。
______________。
参考答案:(1)Cl2+2NaOH="NaCl+" NaClO+H2O? 2NaCl+2 H2O="==2NaOH+" H2↑+ Cl2↑
(2) Cl-+ClO-+ 2H+= H2O+ Cl2↑
(3)空气中的二氧化碳使NaClO生成次氯酸,次氯酸不稳定,见光易分解。
本题解析:略
本题难度:简单
4、选择题 若发生液氯泄漏,下列措施中错误的是( )
A.打电活向有关部门报告
B.组织群众往地势较高的地方转移
C.用石灰水喷洒
D.组织群众顺风转移
参考答案:A.液氯泄漏时,群众专业知识淡薄,应打电活向有关部门报告,如消防部门,故A正确;
B.因氯气的密度比空气的大,地势高的地方氯气含量低,则组织群众往地势较高的地方转移,故B正确;
C.氯气能与碱反应,且石灰水碱性较弱,则可用石灰水喷洒,故C正确;
D.氯气能顺风扩散,则不能组织群众顺风转移,故D错误.
故选D.
本题解析:
本题难度:一般
5、计算题 将4.68gNaNO3、NaCl、Na2CO3的混合物溶于水,向其中滴加30mL1.00mol/LAgNO3溶液后,不再有沉淀生成。过滤后,使沉淀与足量稀硝酸作用,产生112mL(标准状况)气体。计算原混合物中NaCl的质量分数。
参考答案:原混合物中NaCl的质量分数=1.17g/4.68g×100%=25%
本题解析:反应中加入的AgNO3可与NaCl和Na2CO3反应,根据生成的二氧化碳的体积可推算出与Na2CO3反应的AgNO3的量,则可求出与NaCl反应的AgNO3的量,进而计算出原混合物中NaCl的质量及质量分数。
设与Na2CO3反应的AgNO3的物质的量为x,
Na2CO3? ~? 2 AgNO3? ~? CO2
?2mol? 22.4L
x? 0.112L
x=0.01mol
则与NaCl反应的AgNO3的物质的量=0.03L×1.00mol/L-0.01mol=0.02mol
设原混合物中NaCl的质量为y。
NaCl? ~? AgNO3?
58.5g? 1mol
y? 0.02mol
y=1.17g
本题难度:简单