微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 铝在人体内积累可使人慢性中毒,1989年世界卫生组织正式将铝确定为“食品污染源之一”而加以控制。铝在下列使用场合须加以控制的是(? )
①制铝锭?②制易拉罐?③制电线电缆?④制牙膏皮?⑤用明矾净水?⑥制炊具?⑦用明矾和苏打作食物膨化剂?⑧用Al(OH)3制成药片治胃病?⑨制防锈油漆
A.②④⑤⑥⑦⑧
B.②⑤⑥⑦⑨
C.①②④⑤⑥⑦⑧
D.③④⑤⑥⑦⑧
参考答案:C
本题解析:需控制铝的使用的场合,主要是在食品、医药、饮用水等方面。
本题难度:简单
2、填空题 (12分)工业上用铝土矿(主要成分是Al2O3,还有少量的Fe2O3、SiO2)提取冶炼铝的原料氧化铝。工艺流程如下图:
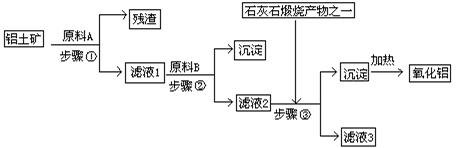
(1)原料A的名称是?,步骤①反应的离子方程式是?。
(2) 滤液1中要加入稍过量原料B,原料B的化学式是?,步骤②反应的离子方程式是:?。
(3) 步骤③的化学方程式是:?。
(4) 如果省去步骤①,即溶解铝土矿是从加入原料B开始,则会对氧化铝的提取有什么影响?。
参考答案:(1)盐酸(硫酸、硝酸)(1分)Al2O3+6H+=2Al3++3H2O(1分)Fe2O3+6H+=2Fe3++3H2O(1分)
(2)NaOH(2分)H++OH-=H2O(1分)Fe3++3OH-=Fe(OH)3 ↓(1分)Al3++4OH-=AlO2-+2H2O(1分)
(3)NaAlO2+CO2+2H2O=Al(OH)3↓+NaHCO3(2分)
(4)若用NaOH溶液溶解铝土矿,则有部分SiO2溶解在NaOH溶液中生成硅酸钠,最后使加热制得的Al2O3混有SiO2杂质(2分)
本题解析:由于步骤③需要的试剂是CO2,所以滤液2中应该是偏铝酸钠,则原料B是氢氧化钠,即滤液1中含有铝离子,所以原料A?是盐酸,残渣是和盐酸不反应的二氧化硅。滤液1中含有氢离子、铝离子和铁离子。加入足量的氢氧化钠后,生成氢氧化铁沉淀,所以滤液2中含有偏铝酸钠和氢氧化钠。然后通入足量的CO2气体,生成氢氧化铝沉淀,氢氧化铝分解即得到氧化铝。而滤液3的主要成分是碳酸氢钠。如果省去步骤①,溶解铝土矿直接从加入原料B开始,则有部分SiO2溶解在NaOH溶液中生成硅酸钠,最后使加热制得的Al2O3混有SiO2杂质。
本题难度:一般
3、填空题 (8分)工业上用铝土矿(主要成分为Al2O3,还有Fe2O3、SiO2)提取氧化铝做冶炼铝的原料,提取的操作过程如下:

(1)铝合金的用途是?;(写出两种即可)
(2)写出加入盐酸后生成Al3+的离子方程式:?
(3)写出固体A中加入烧碱后生成SiO32-的离子方程式:?
(4)验证滤液B中含Fe3+,取少量滤液B并加入?(填试剂名称)
参考答案:(1)建筑业、容器、包装业、交通运输、电子行业等(2分)(写出一点给1分,但最多只给两分)
(2)Al2O3 +6 H+ = 2Al3+ + 3H2O (2分)?(3)SiO2 + 2OH- = SiO32- + H2O (2分)
(4)硫氰化钾或硫氰酸钾(2分)
本题解析:本实验目的为提纯铝土矿,除去杂质Fe2O3、SiO2,获得纯氧化铝;
分析整个实验流程:
第一步.加过量稀盐酸,溶解成铝盐铁盐,过滤,除去不溶的杂质二氧化硅,引入氢离子、氯离子。
第二步. 加过量氢氧化钠使铝盐变成偏铝酸盐, 而铁离子转化为沉淀,过滤除去,引入氢氧根除去氢离子;
第三步.通入过量二氧化碳 生成沉淀氢氧化铝;
第四步.高温灼烧,氢氧化铝受热分解成氧化铝和水。
相关方程式:反应1:Al2O3+6HCl=2AlCl3+3H2O? SiO2+2NaOH=Na2SiO3+H2O
反应2:Al2O3+2NaOH=2NaAlO2+H2O? SiO2+2NaOH=Na2SiO3+H2O
反应3:2NaAlO2+CO2+3H2O=Na2CO3+2Al(OH)3↓
反应4:2Al(OH)3==Al2O3+3H2O
本题难度:一般
4、选择题 相同质量的下列物质分别与等浓度的NaOH溶液反应,至体系中均无固体物质,消耗碱量最多的是
[? ]
A.Al
B.Al(OH)3
C.AlCl3
D.Al2O3
参考答案:A
本题解析:
本题难度:简单
5、选择题 某氧化物不溶于水,溶于NaOH溶液中,生成易溶于水的化合物,向稀盐酸中滴入该溶液,有白色沉淀生成,则原氧化物是(?)
A.Al(OH)3
B.MgO
C.Fe2O3
D.Al2O3
参考答案:D
本题解析:略
本题难度:简单