微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (6分)取一定质量的Al粉和一定质量的某种铁的氧化物混合进行铝热反应,两者恰好完全反应。若在反应后混合物中加入足量的稀硫酸,产生H2的体积为V1L,另取相同质量的Al粉,加入足量稀硫酸,产生H2的体积为V2L(V1,V2均在标况下测定),则V2:V1=4:3。另取相同质量的铁的氧化物,加入盐酸溶解,消耗盐酸的物质的量为2.4mol 。则:(1)写出铝热反应方程式(以FexOy表示铁的氧化物)
_______________________________________________________________________。
(2)此铁的氧化物的化学式为_________。
(3)铝粉的物质的量为____________。
参考答案:
(1)2yAl+3FexOy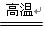 3xFe+yAl2O3(2分)
3xFe+yAl2O3(2分)
(2)Fe3O4(2分)
(3)0.8mol (2分)
本题解析:略
本题难度:简单
2、选择题 下列叙述正确的是
A.金属镁着火时可用干冰灭火
B.二氧化硅可用作光导纤维
C.往氯水中通入SO2后,溶液的漂白性增强
D.由于铝在常温下不与氧气反应,所以铝制品具有抗腐蚀性
参考答案:B
本题解析:A、Mg能在CO2燃烧反应生成C和MgO,所以金属镁着火时不能用干冰灭火,错误;B、光导纤维 由二氧化硅制取,正确;C、往氯水中通入SO2后,Cl2与SO2、H2O反应生成HCl和H2SO4,漂白性减弱,错误;D、由于铝在常温下与氧气反应生成致命的氧化物薄膜,错误。
本题难度:一般
3、填空题 某化学兴趣小组利用废弃铝矿(含CuO、Al2O3及SiO2),模拟工业上提取铝的工艺,设计如下图所示的简单操作流程:

已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
沉淀物
| 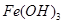
| 
| 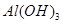
|
开始沉淀
| 2.3
| 7.5
| 3.4
|
完全沉淀
| 3.2
| 9.7
| 4.4
|
?
回答下列问题:
(1)滤渣主要成分的化学式为______________________。
(2)灼烧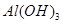 时,用到多种硅酸盐质的仪器,除玻璃棒、酒精灯、泥三角外,还有___________(填仪器名称)。
时,用到多种硅酸盐质的仪器,除玻璃棒、酒精灯、泥三角外,还有___________(填仪器名称)。
(3)溶液Y中要加入稍过量原料A,原料A的化学式是_________,步骤⑤反应的离子方程式是_______________________。
(4)操作流程中③的离子方程式为_______________________。
(5)铝电池性能优越,Al—Ag2O电池可用作水下动力电源,其原理如图所示:
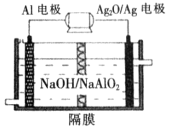
请写出该电池正极反应式_________________;常温下,用该化学电源和惰性电极电解300mL氯化钠溶液(过量),消耗27mg Al,则电解后溶液的pH=_________(不考虑溶液体积的变化)。
(6)以熔融盐为电镀液可以在钢材表面镀铝,镀铝电解池中,钢材为________极;镀铝后能防止钢材腐蚀,其原因是____________________________________。
参考答案:(1)Cu、Fe、SiO2(2分)
(2)坩埚(1分)
(3)NH3?H2O(1分)? Al3++3NH3?H2O=Al(OH)3↓+3NH4+(2分)
(4)2Fe2++H2O2+2H+=2Fe3++2H2O(2分)
(5)Ag2O+2e-+H2O=2Ag+2OH-(2分)? 12(2分)
(6)阴(1分)?在空气中铝表面能形成一层致密的氧化膜,从而保护钢材不被腐蚀(2分)
本题解析:该工艺流程原理为:铝矿加入硫酸,溶解氧化铜、氧化铝,加入过量铁粉,除去溶液中铜离子,过滤,滤渣中主要为Cu、Fe、SiO2,滤液X中含有铝离子、亚铁离子,再加入过氧化氢,将亚铁离子氧化为铁离子,通过调节pH值,使铁离子转化为氢氧化铁而除去,溶液Y含有铝离子,加入氨水,将铝离子转化为氢氧化铝沉淀,加热分解得氧化铝,电解氧化铝生成金属铝。(1)滤渣主要成分的化学式为:Cu、Fe、SiO2。(2)灼烧固体时,要用到坩埚。(3)沉淀Al3+的试剂为氨水,步骤⑤反应的离子方程式是:Al3++3NH3?H2O=Al(OH)3↓+3NH4+。(4)加入过氧化氢,将亚铁离子氧化为铁离子。操作③中的离子方程式为2Fe2++H2O2+2H+=2Fe3++2H2O。(5)正极上氧化银得电子和水反应生成银和氢氧根离子,电极反应式为:Ag2O+2e-+H2O=2Ag+2OH-;根据反应中得失电子数相等计算,消耗27mg Al失去电子0.003mol,则生成氢氧根离子的物质的量为0.003 mol,溶液中氢氧根离子的物质的量的浓度为0.003mol/0.3 L=0.01 mol·L-1,pH=12。(6)电镀池中镀层金属作阳极,待镀金属作阴极,故在钢材表面镀铝,镀铝电解池中,金属铝为阳极,钢材为阴极。在空气中铝表面能形成一层致密的氧化膜,从而保护钢材不被腐蚀。
本题难度:困难
4、选择题 等物质的量的Fe,Mg,Al分别与足量的物质的量浓度相同的盐酸完全反应,消耗盐酸的体积比为( )
A.2:3:1
B.2:2:3
C.3:2:1
D.1:3:2
参考答案:Fe,Mg,Al分别与盐酸反应的方程式为:
Fe+2HCl═H2↑+FeCl2,
Mg+2HCl=MgCl2+H2↑,
Al+3HCl═32H2↑+AlCl3,
设铁、镁、铝的物质的量分别为1mol,根据反应式可知消耗的盐酸的物质的量分别为:2mol,2mol,3mol,
消耗盐酸的物质的量之比为:2:2:3,消耗等浓度盐酸的体积之比也为2:2:3.
故选B.
本题解析:
本题难度:一般
5、选择题 某同学用回收的镁铝合金制取氢气。现有10.8 g镁铝合金,下列说法正确的是(?)
A.常温下与足量18mol/LH2SO4反应,最多可放出0.6 mol H2
B.常温下与足量2mol/LHNO3反应,最少可放出0.45 mol H2
C.常温下与足量2 mol/L H2SO4反应,放出H2的量在0.45 mol~0.6 mol之间
D.常温下与足量2mol/LNaOH反应,放出H2的量在0.45 mol~0.6 mol之间
参考答案:C
本题解析:略
本题难度:简单