微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 某蓄电池放电、充电时的反应为Fe+Ni2O3+3H2O Fe(OH)2+2Ni(OH)2
Fe(OH)2+2Ni(OH)2
下列推断中正确的是( )?
①放电时,Fe为正极,Ni2O3为负极 ②充电时,阴极上的电极反应式是:Fe(OH)2+2e-=Fe+2OH- ③充电时,Ni(OH)2为阳极 ④该蓄电池的电极必须是浸在某种碱性电解质溶液中
A.①②③
B.①②④
C.①③④
D.②③④
参考答案:D
本题解析:根据元素化合价变化,放电时Fe为负极,Ni2O3为正极,①错;充电时,阴极发生还原反应,②对;充电时,Ni(OH)2中Ni元素的化合价升高,因此Ni(OH)2为阳极,③对;因Fe、Ni2O3、Fe(OH)2、Ni(OH)2均可以与酸反应,因此该蓄电池的电极必须浸在碱性电解质溶液中。
本题难度:一般
2、填空题 (10分)(1)在25℃下,向浓度均为0.1 mol·L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成__________沉淀(填化学式),生成该沉淀的离子方程式为____________?。(已知25℃时Ksp[Mg(OH)2]=1.8×10-11,KsP[Cu(OH)2]=2.2×10-20。)
(2)发射飞船时肼(N2H4)与NO2作推力能源,两者反应产生氮气和水蒸气。已知:
①N2(g)+2O2(g)=2NO2(g)?△H="+67.7" kJ/mol
②N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=-534 kJ/mol
则肼与二氧化氮反应的热化学方程式为:?
(3)飞船使用的氢氧燃料电池具有高能、轻便和不污染环境等优点。氢氧燃料电池有酸式和碱式两种,其电池总反应均为:2H2+O2=2H2O。酸式氢氧燃料电池的电解质溶液是强酸溶液,其负极电极反应式可表示为:2H2-4e一=4H+,则其正极反应式为?;碱式氢氧燃料电池中的电解质溶液是强碱溶液,其正极电极反应式可表示为:O2+2H2O+4e一=4OH一,则其负极反应式为?
参考答案:(1)生成Cu(OH)2沉淀(填化学式),离子方程式为Cu2++2NH3·H2O=Cu(OH)2↓+2NH4+。
(2)肼与二氧化氮反应的热化学方程式为:2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g ) △H=-1135.7kJ/mol?
(3)正极反应式为O2+4e-+4H+=2H2O;负极反应式为H2-2e-+2OH-=2H2O
本题解析:(1)由两沉淀的Ksp可知,在c(Mg2+)与c(Cu 2+)相同的情况下, Cu(OH)2的离子积首先超过Ksp,先析出沉淀:Cu2++2NH3·H2O=Cu(OH)2↓+2NH4+
(2)肼与二氧化氮反应的化学方程式为:2N2H4+2NO2=3N2+4H2O,再根据盖斯定律2×②-①可知:2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g ) △H=-1135.7kJ/mol
(3)酸式氢氧燃料电池:由总反应式减去负极反应式可得到正极反应式:O2+4e-+4H+=2H2O;
碱式氢氧燃料电池:由总反应式减去正极电极式可得负极反应式:H2-2e-+2OH-=2H2O
本题难度:一般
3、选择题 若某装置(电解池或原电池)中发生的总反应的离子方程式是Cu+2H+═Cu2++H2↑,则下列关于该装置的有关说法中正确的是( )
A.该装置可能是原电池,也可能是电解池
B.该装置只能是原电池,且电解质溶液为硝酸
C.该装置只能是电解池,且金属铜为该电解池的阳极
D.该装置只能是原电池,电解质溶液不可能是盐酸
参考答案:A、铜和盐酸或稀硫酸不能自发的进行氧化还原反应,铜和硝酸能自发的进行氧化还原反应,但生成的气体是氮氧化物而不是氢气,所以该反应只能是电解池反应而不是原电池反应,所以该装置只能构成电解池不能构成原电池,故A错误;
B、反应是非自发进行的氧化还原反应,需要用电解原理完成,故B错误;
C、该电解池中,阳极上铜失电子发生氧化反应,阴极上氢离子得电子发生还原反应,所以该电解池的阳极必须是铜电极,故C正确;
D、铜和盐酸或稀硫酸不能自发的进行氧化还原反应,铜和硝酸能自发的进行氧化还原反应,但生成的气体是氮氧化物而不是氢气,该反应只能是电解池反应而不是原电池反应,故D错误;
故选C.
本题解析:
本题难度:简单
4、选择题 下图是将SO2转化为重要的化工原料H2SO4的原理示意图,下列说法不正确的是
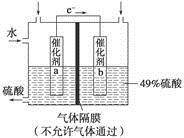
A.该装置将化学能转化为电能
B.催化剂b表面O2发生还原反应,其附近酸性增强
C.催化剂a表面的反应是SO2+2H2O-2e-===SO42-+4H+
D.若得到的硫酸浓度仍为49%,则理论上参加反应的SO2与加入的H2O的质量比为8∶15
参考答案:B
本题解析:该装置为原电池
负极(a)2SO2-4e-+4H2O===8H++2SO42-
正极(b)O2+4e-+4H+===2H2O,A项正确;
B项,酸性应减弱,错误;C项正确;D项,2SO2+O2+2H2O===2H2SO4,
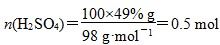
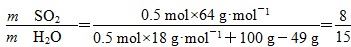
正确。
本题难度:一般
5、选择题 某实验小组依据反应 设计如图原电池,探究pH对AsO43-氧化性的影响。测得电压与pH的关系如图。下列有关叙述错误的是
设计如图原电池,探究pH对AsO43-氧化性的影响。测得电压与pH的关系如图。下列有关叙述错误的是
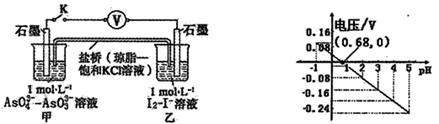
A.调节pH可以改变反应的方向
B.pH = 0.68时,反应处于平衡状态
C.pH = 5时,负极电极反应式为2I--2e- =I2
D.pH >0.68时,氧化性I2〉AsO43-
参考答案:C
本题解析:A、由右图可知,pH>0.68时,电压小于0,反应逆向进行,pH<0.68时,电压大于0,反应正向进行,所以调节pH可以改变反应的方向,正确;B、pH=0.68时,电压为零,反应处于平衡状态,正确;C、pH=5时,电压小于0,反应逆向进行,AsO33-在负极失电子,则负极电极反应式为AsO33--2e-+H2O=AsO43-+2H+,错误;D、pH>0.68时,电压小于0,反应逆向进行,碘作氧化剂,所以氧化性I2>AsO43-,正确,答案选C。
考点:考查原电池反应原理及化学平衡的移动
本题难度:困难