|
高考化学知识点总结《原电池原理》考点预测(2017年强化版)(八)
2017-09-25 17:02:33
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 锌溴液流电池是一种新型电化学储能装置(如图所示),电解液为溴化锌水溶液,电解液在电解质储罐和电池间不断循环。下列说法不正确的是
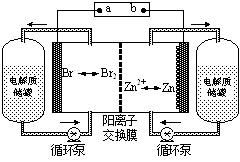
A.充电时电极a连接电源的负极
B.放电时负极的电极反应式为Zn—2e-=Zn2+
C.放电时左侧电解质储罐中的离子总浓度增大
D.阳离子交换膜可阻止Br2与Zn直接发生反应
参考答案:A
本题解析:
试题分析;在充电时,是电能转化为了化学能,相当于是电解池。而在放电时,是化学能转化为电能,相当于是原电池。原电池的正极,连接电解池的阳极,而电解池的阳极链接电源的正极,在电解池中,阴离子向阳极一定,由溴离子向左边移动可知,a应连接原电池的正极。所以A选项是错误的。b应连接原电池的负极,因此在放电时。负极的电极反应式为Zn—2e-=Zn2+故B选项是正确的。C选项,放电时,左侧做正极,放电相当于原电池,因此阳离子向正极反应方向进行,而阳离子交换膜只允许阳离子通过,所以左侧的离子浓度会增大。故C选项是正确的。D选项,阳离子交换膜只允许阳离子通过,因此D选项是正确的。
本题难度:一般
2、选择题 如图装置进行实验,关于此装置,下列的叙述正确的是( )
A.A池是电解池
B.Fe极是阴极
C.B池是原电池
D.B池溶液变红
|
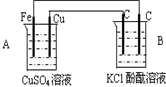
参考答案:A符合原电池的条件,所以是原电池,铁易失电子发生氧化反应而作负极,铜作正极,正极上铜离子得电子发生还原反应,B有外接电源属于电解池,连接铜的碳棒是阳极,连接铁的碳棒是阴极,电解氯化钾溶液时,阳极上氯离子放电生成氯气,阴极上氢离子放电生成氢气,同时电极附近生成氢氧化钾,溶液呈碱性,酚酞遇碱变红色,所以B池溶液变红,故选D.
本题解析:
本题难度:一般
3、选择题 用惰性电极电解V L MSO4的水溶液,当阴极上有m g金属析出(阴极上无气体产生)时,阳极上产生x L气体(标准状况),同时溶液的pH由原来的6.5变为2.0(设电解前后溶液体积不变)。则M的相对原子质量的表示式为(? )
A.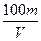
B.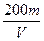
C.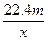
D.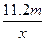
参考答案:BD
本题解析:4OH--4e-====2H2O+O2↑
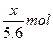 ? ?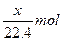
同时产生H+:n(H+)=".01V" mol
由得失电子守恒得:n(M)=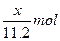 = =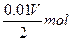
故:Mr=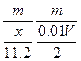
本题难度:简单
4、填空题 (12分)丙烷在燃烧时能放出大量的热,它是液化石油气的主要成分,作为能源应用于人们的日常生产和生活。?
已知:①2C3H8(g) +7O2(g) =" 6CO(g)" + 8H2O(l)?△H1= -2741.8kJ/mol
②2CO(g) + O2(g) = 2CO2(g)?△H2= -566kJ/mol
(1)反应C3H8(g) +5O2(g) = 3CO2(g) +4H2O(l)的△H=?
(2)现有1mol C3H8在不足量的氧气里燃烧,生成1mol CO和2mol CO2以及气态水,将所有的产物通入一个固定体积为1L的密闭容器中,在一定条件下发生如下可逆反应:
CO(g) + H2O(g)  ?CO2(g) + H2(g)△H1=" +" 41.2kJ/mol ?CO2(g) + H2(g)△H1=" +" 41.2kJ/mol
5min后体系达到平衡,经测定,H2为0.8mol,则v(H2)=?,此过程吸收的热量为________________________.
(3)依据(1)中的反应可以设计一种新型燃料电池,一极通入空气,另一极通入丙烷气体;燃料电池内部是熔融的掺杂着氧化钇(Y2O3)的氧化锆(ZrO2)晶体,在其内部可以传导O2—。在电池内部O2—由____极移向____极(填“正”或“负”);电池的负极电极反应式为?。
(4)用上述燃料电池用惰性电极电解足量Mg(NO3)2和NaCl的混合溶液。电解开始后阴极的现象为____?。
参考答案:(1)-2219.9kJ/mol(2分)?(2)0.16mol/L?min-1 (2分), 32.96kJ(2分)
(3)正(1分),负(1分), C3H8 + 10O2- -20e- =3CO2 +4H2O(2分)
(4)有无色气体生成,有白色沉淀生成。(2分)
本题解析:(1)根据盖斯定律可知,(①+②×3)÷2,即得到C3H8(g) +5O2(g) = 3CO2(g) +4H2O(l),所以反应热是△H=(-2741.8kJ/mol-566kJ/mol×3)÷2=-2219.9kJ/mol。
(2)反应速率通常用单位时间内浓度的变化量来表示,所以氢气的反应速率是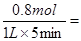 0.16mol/L?min-1 ;根据热化学方程式可知,吸热的热量是41.2kJ/mol×0.8mol=32.96kJ。 0.16mol/L?min-1 ;根据热化学方程式可知,吸热的热量是41.2kJ/mol×0.8mol=32.96kJ。
(3)原电池中阳离子向正极移动,阴离子向负极移动。负极失去电子,所以丙烷在负极通入,则负极方程式为C3H8 + 10O2- -20e- =3CO2 +4H2O。
(4)电解池中阴极是得到电子的,所以溶液中的氢离子在阴极放电生成氢气,从而破坏了阴极周围水的电离平衡,产生OH-,所以阴极还产生白色沉淀氢氧化镁。
本题难度:一般
5、填空题 (10分)(1)将锌、铜用导线连接后浸入2mol/L的稀硫酸中,正极电极反应式为_____________________________,发生 反应(填氧化或还原);电子从
经外电路到 (填锌或铜),溶液中H+ 向 移动(填正极或负极),放电一段时间后,正极区pH值 (填变大、变小或不变)。
(2)将铜片和铁片用导线连接后插入三氯化铁溶液中,也有电流通过电流表。
负极电极反应式为_________________,
总反应的离子方程式为______ 。
(3)将铁片和石墨电极用导线连接后插入氯化钠溶液并露置在空气中,也有电流通过电流表,请写出负极电极反应式____________,正极电极反应式为_____________。
参考答案:(1)2H++2e-=H2↑ 还原 锌 铜 正极 变大
(2) Fe-2e-= Fe2+ Fe+2Fe3+=3Fe2+
(3)负极:2Fe-4e-=2Fe2+ 正极: O2+4e-+2H2O=4OH-
本题解析:(1)在原电池中较活泼的金属作负极,失去电子被氧化,发生氧化反应。电子经过导线传递到正极是,所以溶液中的阳离子向正极移动,在正极得到电子,发生还原反应。
(2)将铜片和铁片用导线连接后插入三氯化铁溶液中,此时铁是负极,失去电子被氧化而溶解。铜是正极,溶液中的铁离子得到电子,被还原生成亚铁离子。
(3) 将铁片和石墨电极用导线连接后插入氯化钠溶液并露置在空气中,此时将发生铁的吸氧腐蚀,铁作负极。石墨作正极,溶解在溶液中的氧气得到电子。
本题难度:一般
| 