微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、简答题 铁在氯气中燃烧
参考答案:2Fe+ 3Cl2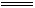 2FeCl3
2FeCl3
本题解析:氯气具有强氧化性,可将铁氧化为高价的氯化铁:2Fe+ 3Cl2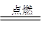 2FeCl3
2FeCl3
本题难度:简单
2、实验题 工业上常通过高温分解FeSO4的方法制备Fe2O3,其化学方程式为:
2FeSO4 ="===" Fe2O3 +SO2↑+SO3↑?为检验FeSO4高温分解的产物,进行如下实验:
①取少量FeSO4高温分解得到的固体,加一定量稀盐酸溶解,向该溶液中加入适量的KSCN溶液,观察溶液颜色的变化以检验Fe3+是否存在。
②将FeSO4高温分解产生的气体通入右图所示的装置中,以检验产生的气体中是否含有SO2和SO3。请回答以下问题:

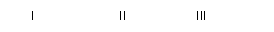
(1)写出用KSCN检验Fe3+的离子方程式?。
(2)装置I中试剂为氯化钡溶液,进行操作②时氯化钡溶液中有白色沉淀产生。甲同学说,这个白色沉淀可能是BaSO4和BaSO3的混合物;乙同学说,这个白色沉淀是BaSO4;丙同学说,这个白色沉淀是BaSO3。请你设计一个简单的实验帮他们加以鉴别。
?
你认为上述哪一位同学的观点正确??
(3)装置II中试剂为品红溶液,其作用是?,品红溶液中可观察到现象是?。
(4)装置III中试剂为NaOH溶液,其目的是?。
参考答案:(1)Fe3++3SCN-=Fe(SCN)3
?(2)取Ⅰ中白色沉淀,加入足量稀盐酸,若沉淀不溶解且无气泡产生,则沉淀为BaSO4
乙
(3)检验产生的气体中含SO2,品红溶液褪色
(4)除去多余的SO2,防止污染空气。
本题解析:略
本题难度:一般
3、选择题 FeS2结构类似于Na2O2,与酸反应时生成H2S2,H2S2类似于H2O2,易分解。实验室用稀盐酸制取H2S时,某学生误将FeS2颗粒当作FeS使用,当FeS2反应完后,不可能生成的物质是:(? )
A.H2S
B.S
C.FeS
D.FeCl2
参考答案:C
本题解析:FeS2与酸反应时生成H2S2,H2S2类似于H2O2,易分解,所以反应中的生成物有氯化亚铁、单质S和H2S,但不可能生成FeS,答案选C。2的性质
点评:该题是信息给予题,属于中等难度的试题,主要是有利于培养学生的自学能力和逻辑思维能力,以及知识的迁移能力,提高学生灵活运用基础知识解决界实际问题的能力。
本题难度:简单
4、填空题 化学兴趣小组为探究某铁矿石(主要成分为Fe203和Si02)的性质,进行如下实验:
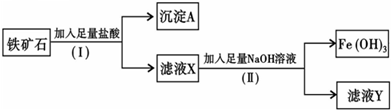
(1)步骤(I)中分离溶液和沉淀的操作名称是______;
(2)沉淀A中一定含有______,该物质属于______(填“酸性”或“碱性”)氧化物;
(3)往滤液Y中加入KSCN溶液,溶液呈______(填“黄色”或“红色”);
(4)写出步骤(Ⅱ)中生成Fe(OH)3的离子方程式______.
参考答案:(1)铁矿石的主要成分为Fe203和Si02,加入足量盐酸后,氧化铁与盐酸反应生成氯化铁和水,二氧化硅为难溶物且不与盐酸反应,可以通过过滤的方法分离,
故答案为:过滤;
(2)二氧化硅不与盐酸反应,所以过滤后得到的沉淀A为SiO2;二氧化硅能够与强碱溶液反应生成盐和水,所以二氧化硅属于酸性氧化物,
故答案为:SiO2;酸性氧化物;
(3)滤液中含有铁离子,铁离子能够与硫氰根离子反应生成红色的硫氰化铁,
故答案为:红色;
(4)步骤Ⅱ为铁离子与氢氧化钠溶液反应生成氢氧化铁沉淀,反应的离子方程式为:Fe3++3OH-═Fe(OH)3↓,
故答案为:Fe3++3OH-═Fe(OH)3↓.
本题解析:
本题难度:一般
5、填空题 (一)含铜物质是化学中的重要试剂。例如利用新制氢氧化铜悬浊液验证葡萄糖的还原性。
新制氢氧化铜悬浊液的配制与应用:
(1)实验室制取新制氢氧化铜悬浊液的操作方法:在试管里加入10%的________溶液2mL,滴入2%的_________溶液4~6滴(以上选填“硫酸铜”或“氢氧化钠”),振荡即成。这样操作的目的_______________________________________________。
(2)下列各组物质的溶液仅用新制的氢氧化铜悬浊液(必要时可以加热)不能检验出来的是______。
A.HCOOCH3,C6H5COOH,C6H5CH2OH
B.NaHSO4,BaCl2,Na2CO3,酚酞
C.HCOOH,HCOONa,HCOOCH2CH3
D.葡萄糖,CH2OHCHOHCH2OH