微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 某课外实验小组设计的下列实验不合理的是
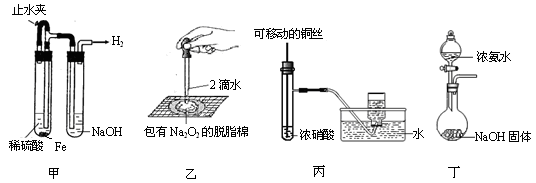
A.甲可用于制备并观察氢氧化亚铁沉淀
B.乙可用于证明过氧化钠与水反应放热
C.丙可用于制备并收集少量NO2气体
D.丁可用于实验室制备少量氨气
参考答案:C
本题解析:A.在左边的试管中发生反应Fe+H2SO4=FeSO4+H2↑,产生的氢气通过导气管进入到右边的试管中把NaOH溶液中的空气赶走,然后关闭止水夹,这时左边的FeSO4溶液在氢气的压强下被压入到右边的试管中发生反应:FeSO4+2NaOH=Na2SO4+Fe(OH)2↓.由于氢氧化亚铁沉淀处于氢气的环境在,不能被空气氧化,所以可较长时间观察氢氧化亚铁的沉淀。正确。B.2Na2O2+2H2O=4NaOH+O2↑.如果反应放热,放出的热量能使棉花燃烧起来。故乙可用于证明过氧化钠与水反应放热。正确。C.Cu+ 4HNO3(浓) =Cu(NO3)2+2NO2↑+2H2O. 但是二氧化氮与水发生反应3NO2+H2O=HNO3+NO.,所以不能用于收集气体。错误。D.NaOH固体有吸水性,溶解于水放出热量,使一水合氨发生分解反应:NH3?H2O NH3↑+H2O。故丁可用于实验室制备少量氨气。正确。2、Na2O2、NO2、、NH3的制取、收集及检验等知识。
NH3↑+H2O。故丁可用于实验室制备少量氨气。正确。2、Na2O2、NO2、、NH3的制取、收集及检验等知识。
本题难度:一般
2、选择题 X、Y、Z是1~18号的三种元素,它们的离子具有相同的电子层结构.若Y与Z能形成YZ3型离子化合物,Z的离子半径大于X离子的半径,则三种元素的原子半径由大到小的顺序是( )
A.X>Y>Z
B.Y>X>Z
C.X>Z>Y
D.Z>X>Y
参考答案:X、Y、Z是1~18号的三种元素,它们的离子具有相同的电子层结构.若Y与Z能形成YZ3型离子化合物,则Y为Al、Z为F,Z的离子半径大于X离子的半径,则X为Na或Mg,结合同周期自左而右原子半径减小,同主族自上而下原子半径增大,故原子半径X>Y>Z,
故选A.
本题解析:
本题难度:简单
3、简答题 下表是元素周期表的一部分.
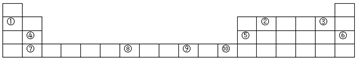
(3)②元素位于第______周期第______族,最高正价为______,最低负价为______.④元素位于第______周期第______族,最高正价为______.
参考答案:由元素在周期表中的位置可知,元素②处于第二周期第ⅣA族,该元素最高正化合价=主族族序数=最外层电子数=4,最低负化合价=最外层电子数-8=4-8=-4;
元素④处于第三周期第ⅡA族,该元素最高正化合价=主族族序数=最外层电子数=2;
故答案为:二,Ⅳ,+4,-4;三、Ⅱ,+2.
本题解析:
本题难度:一般
4、选择题 短周期元素W、X、Y、Z在元素周期表中的位置如下图所示。下列说法正确的是
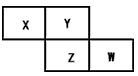
[?]
A.Y的原子半径在同主族元素中最大
B.W的最高价氧化物对应的水化物是酸
C.W的非金属性比Z的弱
D.Z的气态氢化物的稳定性在同主族元素形成的氢化物中最强
参考答案:B
本题解析:
本题难度:简单
5、推断题 在元素周期表中,一稀有气体元素原子的最外层电子构型为4s24p6,与其同周期的 A、B、C、D四种元素,它们的原子最外层电子数依次为2、2、1、7。其中A、C两元素原子的次外层电子数为8,B、D两元 素原子的次外层电子数为18,E、D两元素处于同族,且在该族元素中,E的气态氢化物的沸点最高。
(1)B元素在周期表中的位置__________________; D元素基态原子电子排布式为___________________。
(2)E的氢化物在同族元素中沸点最高的原因是_____________________。
(3)A、C两元素第一电离能_______>_______。(填元素符号)
(4)B元素能形成多种配合物。元素之间形成配合物的条件是:一方是能够提供孤电子对的原子或离子,另一方是___________的原子。
(5)A元素可与氢元素形成离子化合物,电子式为____________;这种离子化合物可与水反应,化学方程式为________________________。
参考答案:
(1)第4周期ⅡB族;1s22s22p63s23p63d104s24p5或[Ar]3d104s24p5
(2)E的氢化物分子间存在氢键,破坏它需要较高的能量,所以沸点较高
(3)Ca;K
(4)具有能够接受孤电子对的空轨道
(5)[H:]-Ca2+[:H]-;CaH2+2H2O = Ca(OH)2+2H2↑
本题解析:
本题难度:一般