微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 常温下,往H2O2溶液中滴加少量FeSO4溶液,可发生如下两个反应:
2Fe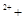 H2O2
H2O2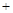 2H
2H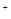 → 2Fe
→ 2Fe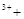 2H2O 2Fe
2H2O 2Fe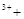 H2O2 → 2Fe
H2O2 → 2Fe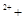 O2↑
O2↑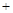 2H
2H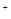
下列说法正确的是( )
A.H2O2的氧化性比Fe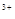 强,其还原性比Fe
强,其还原性比Fe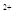 弱
弱
B.在H2O2分解过程中,溶液的pH逐渐下降
C.在H2O2分解过程中,Fe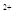 和Fe
和Fe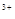 的总量保持不变
的总量保持不变
D.H2O2生产过程要严格避免混入Fe
参考答案:CD
本题解析:首先要明确铁离子是起催化剂的作用,两个反应相加得2H2O2=2H2O+O2↑。因此在分解过程中H+的浓度不变,故溶液的pH不变。由于双氧水的量远大于亚铁离子,而且两个反应循环进行,故亚铁离子、铁离子的总量不变。在双氧水的生成中要避免其分解,故D的说法正确。对于A选项,第一个反应是在酸性条件下,得出的结论是正确的,但是第二个反应是在中性条件下进行的,得出的结论相反,故要比较其氧化还原性要指明反应条件的介质。答案选CD。
本题难度:一般
2、选择题 对于反应M+N=P,如果温度每升高10 ℃,反应速率增大为原来的3倍。在10 ℃时完成反应的10%需要54 min,将温度提高到40 ℃完成反应的10%,需要的时间为(? )。
A.2 min
B.3 min
C.6 min
D.9 min
参考答案:A
本题解析:本题要弄清两个问题:①时间与速率关系,②速率与温度关系。因每升高10 ℃反应速率增大为原来的3倍,如升高的温度为Δt,则反应速率增加为原来的 倍,反应温度由10 ℃升至40 ℃,反应速率增加为原来的33倍,完成反应的10%需要时间为
倍,反应温度由10 ℃升至40 ℃,反应速率增加为原来的33倍,完成反应的10%需要时间为 ="2" min。
="2" min。
本题难度:一般
3、简答题 某温度时,在一个2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示.根据图中数据,试填写下列空白:
(1)该反应的化学方程式为______;
(2)从开始至2min,Z的平均反应速率为______;Y的平均反应速率为______.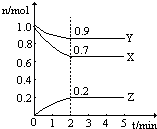
参考答案:(1)由图象可以看出,反应中X、Y的物质的量减小,Z的物质的量增多,则X、Y为反应物,Z为生成物,
且△n(X):△n(Y):△n(Z)=0.3mol:0.1mol:0.2mol=3:1:2,则反应的化学方程式为:3X+Y
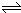
2Z,
故答案为:3X+Y
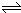
2Z;
(2)在2min时间内,用Z表示反应的平均速率v(Z)=△C(Z)△t=0.2mol2L2min=0.05mol/(L?min),
用Y表示的平均反应速率为v(Y)=12×0.05mol/(L?min)=0.025mol/(L?min);
故答案为:0.05mol/?(L?min);0.025mol/(L?min)
本题解析:
本题难度:一般
4、选择题 现有反应:Na2S2O3+H2SO4=Na2SO4+SO2+S↓+H2O,下列各组实验中最先出现浑浊的是
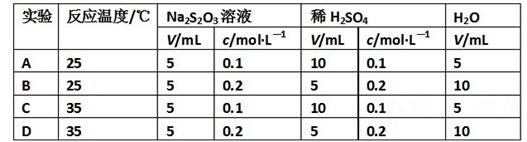
参考答案:D
本题解析:首先考虑温度,排除了AB,其次考虑浓度,CD两种情况下,混合以后总的体积都是20mL,那么相比较而言,D选项中的硫代硫酸钠的浓度要比C中的大,因此选D。
本题难度:一般
5、填空题 个化学反应,我们不但关心物质变化和能量变化,还通常要研究化学反应的快慢

(1)用纯净的锌粒和盐酸反应制取氢气,回答:
实验过程如下图所示,分析判断:________段化学反应速率最快,原因是?,_______段收集的氢气最多。
为了加快上述反应的速率,欲向溶液中加入一定量下列物质,你认为可行的是?
A.胆矾晶体? B.硫酸氢钠固体
C.氯化锌浓溶液? D.浓硝酸
除了上述方法外,你认为还可以采取?措施来加快化学反应速率。
(2)下图表示800℃时,A、B、C三种气体物质的浓度随时间变化的情况,t是达到平衡状态的时间。
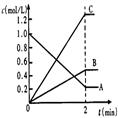
试回答
①该反应的化学方程式为_________________________________。
②达到平衡状态的所需时间是2min,A物质的平均化学反应速率为______?______
参考答案:(1)EF;反应放热,溶液温度升高,反应速率加快;EF;AB;加热或把锌处理成小颗粒;施来加快化学反应速率
(2)①2A B+3C?②0.4mol/(L·min)
B+3C?②0.4mol/(L·min)
本题解析:(1)反应速率越快,则曲线的斜率越大,所以根据图像可知,EF段反应速率最快。这是由于反应放热,溶液温度升高,反应速率加快;根据纵坐标的变化可知,EF 段产生的氢气最多;胆矾溶于水,锌能置换出铜,从而构成铜锌原电池,加快反应速率,A正确;硫酸氢钠溶于水电离出氢离子,增大氢离子浓度,反应速率加快,B正确;氯化锌的浓溶液不能改变氢离子的浓度,反应速率变化不大,C错误;硝酸是氧化性酸,和锌反应得不到氢气,D不正确,答案选AB;由于温度和固体的表面积也可以改变反应速率,所以加热或把锌处理成小颗粒;施来加快化学反应速率。
(2)①根据图像可知,反应进行到2min时物质的浓度不再发生变化,反应达到平衡状态。其中A的浓度减少了0.8mol/L,B和C的浓度分别增加了0.4mol/L和1.2mol/L,则根据变化量之比是化学计量数之比可知,该反应的方程式是2A B+3C。
B+3C。
②平衡时A的反应速率是0.8mol/L÷2min=0.4 mol/(L·min)。
点评:该题是高考中的常见题型,属于基础性试题的考查。试题基础性强,侧重对学生基础知识的训练,有利于培养学生灵活运用基础知识解决实际问题的能力,提高学习效率。该题的关键是明确反应速率的含义和表达式,然后结合题意灵活运用即可。
本题难度:一般