微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题
A.0.5
B.1.7
C.2
D.13.2
参考答案:B
本题解析:两溶液反应后,硫酸过量,剩余H+的物质的量为:0.04 L×2×0.4 mol·L-1-0.06 L×0.5 mol·L-1=2×10-3 mol。c(H+)=2×10-2 mol·L-1,pH=1.7。
本题难度:简单
2、选择题 水的电离平衡曲线如图所示,下列说法不正确的是:
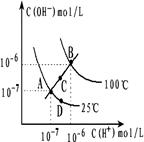
A.图中四点Kw间的关系: A=D<C<B
B.若从A 点到D点,可采用:温度不变在水中加入少量酸
点到D点,可采用:温度不变在水中加入少量酸
C.若从A点到C点,可采用:温度不变在水中加入少量NH4Cl固体
D.若处在B点,将pH=2的硫酸与pH=10的KOH的两种溶液等体积混合后,溶液显中性
参考答案:C
本题解析:略
本题难度:一般
3、选择题 95℃时某溶液的pH=6,对该溶液的判断正确的是
A.呈酸性
B.c(H+)=1×10-6mol/L
C.c(OH-)=1×10-6mol/L
D.无法判断
参考答案:B
本题解析:考查pH的概念和溶液酸碱性的判断。溶液中氢离子浓度的负对数称为溶液的pH。pH=6,所以氢离子的浓度是1×10-6mol/。由于无法确定该温度下的水的离子积常数,所以溶液的酸碱性无法确定。答案选B。
本题难度:一般
4、选择题 下列四种溶液①pH=0的盐酸②0.1 kJ·mol-1的盐酸③0.01 kJ·mol-1的NaOH溶液?④pH=11的NaOH溶液由水电离出的氢离子浓度之比为
A.1∶10∶100∶1000
B.0∶1∶12∶11
C.14∶13∶12∶11
D.14∶13∶2∶3
参考答案:A
本题解析:①pH=0的盐酸由水电离出的氢浓度为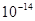 ,②0.1 kJ·mol-1的盐酸由水电离出的氢浓度为
,②0.1 kJ·mol-1的盐酸由水电离出的氢浓度为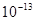 ,③0.01 kJ·mol-1的NaOH溶液由水电离出的氢浓度为
,③0.01 kJ·mol-1的NaOH溶液由水电离出的氢浓度为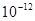 ,④pH=11的NaOH溶液由水电离出的氢离子浓度为
,④pH=11的NaOH溶液由水电离出的氢离子浓度为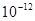 ,所以正确选项为A;
,所以正确选项为A;
本题难度:一般
5、选择题 25°C时,pH=7的(NH4)2SO4与NH3·H2O的混合溶液中,c(NH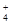 )与c(SO
)与c(SO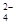 )之比是? (? )
)之比是? (? )
A.等于2∶1
B.大于 2∶1
C.小于2∶1
D.无法判断
参考答案:A
本题解析:
【错解分析】不少同学认为NH3·H2O过量溶液呈碱性,继而推断出c(NH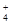 )与c(SO
)与c(SO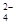 )之比大于2∶1。已学的知识对新学的知识产生了消极的干扰作用叫“负迁移”,有些知识从面上看来有其共同点(是产生知识迁移的前提),而其实则不然。
)之比大于2∶1。已学的知识对新学的知识产生了消极的干扰作用叫“负迁移”,有些知识从面上看来有其共同点(是产生知识迁移的前提),而其实则不然。
【正解】抓住问题的本质,因为混合溶液的pH=7,故c(H+)=c(OH-);由电荷守恒原理有关系式:c(H+)+c(NH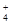 )=c(OH-)+2c(SO
)=c(OH-)+2c(SO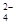 ),故c(NH
),故c(NH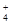 )=2 c(SO
)=2 c(SO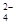 )。
)。
本题难度:简单