微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、简答题 表是元素周期表的一部分,回答下列有关问题:
族
周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0
2
①
②
3
③
④
⑤
⑥
⑦
⑧
⑨
4
⑩
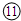
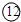
|
(1)在这些元素的最高价氧化物对应水化物中,酸性最强的是(填化学式,下同)______,碱性最强的是______,呈两性的氢氧化物是______,
(2)写出工业上冶炼⑤的化学方程式为______;⑤与一种黑色晶体反应冶炼铁的化学方程式为:______.
(3)在⑧与⑦中,非金属性较强的元素是______,写出可以验证该结论的一个离子反应方程式______.
参考答案:由元素在周期表的位置可知,①为N,②为F,③为Na,④为Mg,⑤为Al,⑥为Si,⑦为S,⑧为Cl,⑨为Ar,⑩为K,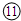 为Ca,
为Ca,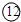 为Br,
为Br,
(1)最高价氧化物对应水化物中,Cl的最高价氧化物的水化物酸性最强,该酸为HClO4,K的最高价氧化物的水化物碱性最强,该碱为KOH,氢氧化铝为两性氢氧化物,该两性氢氧化物为Al(OH)3,故答案为:HClO4;KOH;Al(OH)3;
(2)电解法冶炼Al,该反应为2Al2O3(熔融)电解.冰晶石4Al+3O2↑;Al与四氧化三铁反应生成Fe,该反应为3Fe3O4+8Al高温.9Fe+4Al2O3,
故答案为:2Al2O3(熔融)电解.冰晶石4Al+3O2↑;3Fe3O4+8Al高温.9Fe+4Al2O3;
(3)Cl、S位于同周期,原子序数大的非金属性强,非金属性Cl>S,可利用非金属单质之间的置换反应说明,如Cl2+S2-=S↓+2Cl-,故答案为:Cl;Cl2+S2-=S↓+2Cl-.
本题解析:
本题难度:一般
2、选择题 下列四种元素中非金属性最强的是
[? ]
A.原子最外层电子数为次外层电子数三倍的元素
B.第三周期ⅢA族元素
C.第16号元素
D.负1价阴离子核外电子排布与氖原子相同的元素
参考答案:D
本题解析:
本题难度:简单
3、选择题 下列关于物质性质变化的比较,不正确的是( )
A.酸性强弱:H2SO4>H2SiO3>H3PO4
B.原子半径大小:Na>S>O
C.碱性强弱:KOH>NaOH>LiOH
D.金属性强弱:Na>Mg>Al
参考答案:A.非金属性:S>P>Si,元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强,
则有H2SO4>H3PO4>H2SiO3,故A错误;
B.同周期元素从左到右原子半径逐渐减小,则原子半径Na>S,同主族元素的原子半径从上到下逐渐增大,则原子半径S>O,所以原子半径大小:Na>S>O,故B正确;
C.金属性:K>Na>Li,元素的金属性越强,对应的最高价氧化物的水化物的碱性越强,则碱性强弱:KOH>NaOH>LiOH,故C正确;
D.同周期元素从左到右元素的金属性逐渐减弱,则金属性强弱:Na>Mg>Al,故D正确.
故选A.
本题解析:
本题难度:简单
4、填空题 按已知的原子结构规律,82号元素X应是第___________周期___________族元素,它的最高正价氧化物的化学式为______________。
参考答案:6 ;ⅣA ;PbO2
本题解析:
本题难度:一般
5、推断题 短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族族序数相等,请回答下列问题:
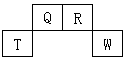
(1)T元素的原子结构示意图为____________,Q元素在元素周期表中的位置为____________,R元素单质的电子式为____________。
(2)原子序数比T少2的元素是____________(填元素符号),用电子式表示该元素与W元素形成化合物的过程________________________。
(3)原子序数比W多4的元素是____________(填元素符号),该元素最高价氧化物的水化物溶液与W元素最高价氧化物的水化物溶液反应的离子方程式为:________________________。
参考答案:(1) ;第二周期ⅣA族;
;第二周期ⅣA族;
(2)Na;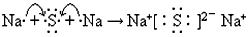
(3)Ca;Ca2++2OH-+2H++SO42-== CaSO4↓+2H2O
本题解析:
本题难度:一般