微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、简答题 为测定Na2CO3与Na2SO3混合物中各组分的含量,欲取样品m?g以图所示装置进行实验,已知仪器C中装有品红溶液.(铁架台、铁夹等仪器未在图中画出)
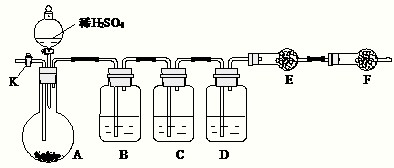
(1)将仪器连接好以后,必须进行的第一步操作是______.
(2)此实验还必须用到的最重要的仪器是______;仪器F的作用是______.
(3)实验室中备有以下常用试剂:
a.浓硫酸? b.品红溶液?c.酸性高锰酸钾溶液?d.饱和碳酸氢钠溶液 e.氢氧化钠溶液?
f.无水硫酸铜?g.碱石灰?h.五氧化二磷?i.无水氯化钙
请将下列容器中应盛放的试剂序号填入相应空格:B中______,D中______,E中______.
(4)实验过程中,当仪器A内的固体反应完全后,需打开活塞K,向A中通入大量的空气.这样做的目的是______.
所通空气应先经过______试剂(填序号)处理,否则可能引起Na2SO3?含量的测量结果比实际值______(填“偏高”、“偏低”或“无影响”).
(5)若要提高实验的准确性,还应在______之间增加装有______(填序号)的球形干燥管装置.
参考答案:由装置图可知,实验原理为:混合物中加入硫酸,转化为二氧化硫、二氧化碳,除去反应生成的二氧化硫,利用E装置的增重确定生成的二氧化碳的质量,根据二氧化碳的质量计算混合物中碳酸钠的质量,进而计算各组分的质量分数.
(1)由于需要测定二氧化碳的质量,整套装置应气密性良好,故实验之前应检验装置的气密性;
故答案为:检验装置的气密性;
(2)实验测定二氧化碳的质量,进而计算碳酸钠的质量,要计算质量分数,需要知道样品的总质量,故应需要用托盘天平称量样品的质量;
利用E装置的增重确定生成的二氧化碳的质量,故F装置目的是防止空气中的水蒸气、二氧化碳进入E装置中,影响测量结果;
故答案为:托盘天平;防止空气中的水蒸气、二氧化碳进入E装置中;
(3)进入装置E中的二氧化碳要干燥、不含二氧化硫,故装置B的作用是除去气体中的二氧化硫,试剂保证吸收二氧化硫,不能吸收二氧化碳且不能生成二氧化碳,故选择c(酸性高锰酸钾溶液);
装置C的作用是具有二氧化硫是否除尽,装置D的作用是干燥气体,选择试剂为a(浓硫酸);
E装置的作用是吸收生成的二氧化碳,确定二氧化碳的质量,故可以选择g(碱石灰);
故答案为:c;a;g;
(4)装置内会残留部分二氧化碳,应使二氧化碳区别被装置E中药品吸收,故通入大量的空气目的是排尽装置内的二氧化碳,使生成的二氧化碳能够全部装置E中药品吸收.
由于空气中含有二氧化碳,应先除去空气中的二氧化碳,若不除去空气中的二氧化碳,导致测定二氧化碳的质量增大,计算所得碳酸钠的质量增大,引起测定的a2S03质量减小,导致Na2SO3含量偏低,可以使空气先通过氢氧化钠溶液或碱石灰除去含有的二氧化碳;
故答案为:使生成的二氧化碳能够全部装置E中药品吸收;e或g;偏低;
(5)装置E吸收二氧化碳后会生成水,防止装置D的浓硫酸吸收影响二氧化碳的质量测定,故在在D与E之间之间增加装有 氯化钙的球形干燥管装置;
故答案为:在D与E,i.
本题解析:
本题难度:一般
2、实验题 在化学研究领域,经常需要对一些物质进行性质的确定。如利用下列装置(夹持仪器已略去)测出一定质量镁与盐酸反应放出的气体体积,对金属镁的相对原子质量进行测定,实验步骤如下

①准确称量mg金属镁(已除去表面氧化膜),用铜网包住放入干净的试管中;
②按图示组装好装置,然后在关闭活塞的分液漏斗中装入一定体积2mol/L的盐酸;
③调整右边玻璃管(带均匀刻度值),让U型管两端液面在同一水平面,读出右边玻璃管的液面刻度值为V1mL;
④打开分液漏斗活塞,让一定量的盐酸进入试管中后立即关闭活塞;
⑤当镁条反应完后,_______________,读出右边玻璃管的液面刻度为V2mL。
请回答下列问题:
(1)写出你认为步骤⑤中空格应进行的操作。
(2)若V1,V2均是折算为标况下的值,则镁的相对原子质量Ar(Mg)的实验测定表达式为Ar(Mg)=_________,你认为此表达式求出的值是否准确?______(填‘是’或‘不’),主要问题为________________(若回答‘是’则此空不填)。
(3)步骤①中,为什么要用铜网包住镁条?_________________。
参考答案:(1)等装置冷却至室温后,再上下调节右边玻璃管的高度,使两端管内液面在同一水平面
(2)22400m/(V2-V1);不;进入试管中的盐酸的体积也计入了产生的气体体积中
(3)让镁条浸没在盐酸中,防止镁与氧气反应,使镁全部用来产生氢气
本题解析:
本题难度:一般
3、选择题 下列装置或操作不能达到实验目的的是
[? ]
A. 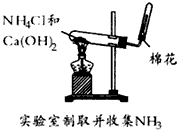
B. 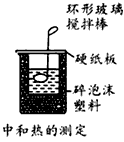
C. 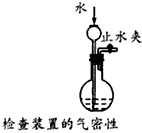
D. 
参考答案:B
本题解析:
本题难度:一般
4、简答题 实验室有一瓶亚硫酸钠试剂,有部分己被氧化成硫酸钠.某学生设计了下列实验来测定其中Na2SO4的质量分数.(已知:2HCl+Na2SO3=2NaCl+SO2↑+H2O、Na2SO3+BaCl2=BaSO3↓+2NaCl)
(1)称取样品a克,并溶解在一定量的水中.
(2)往溶液中加盐酸,直至盐酸过量.
(3)往酸化的溶液中加入过量的BaCl2溶液.
(4)过滤,并洗涤.烘干得沉淀b克.
试回答:
(5)加盐酸为什么要过量?______
(6)如何验证氯化钡已经过量?______.
参考答案:由方案设计可知,该方案原理为加入盐酸将溶液中的亚硫酸根转化为二氧化硫除去,再加入过量的氯化钡将硫酸根转化为硫酸钡沉淀,通过测量硫酸钡的质量,计算样品中硫酸钠的质量,进而计算样品硫酸钠的质量分数.
(5)由于亚硫酸钠与氯化钡发生反应Na2SO3+BaCl2=BaSO3↓+2NaCl,影响硫酸钡质量的测定,故应加入过量的盐酸,除去溶液中的亚硫酸根,
故答案为:除去溶液中的SO32-,防止干扰硫酸钡质量的测定;
(6)只要有硫酸钠存在加入氯化钡就会产生白色沉淀,所以检验上清液中是否含有硫酸根,方法是:取上层清液再加入氯化钡溶液,若不再生成白色沉淀,说明氯化钡已经过量,
故答案为:取上层清液再加入氯化钡溶液,若不再生成白色沉淀,说明氯化钡已经过量.
本题解析:
本题难度:一般
5、选择题 向碘水中加入适量CCl4并振荡,静置后观察到的现象是?
[? ]
A.形成均匀的无色溶液?
B.形成均匀的紫红色溶液
C.液体分层,下层呈紫红色?
D.液体分层,上下层均呈无色
参考答案:C
本题解析:
本题难度:简单