微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 欧盟原定于2012年1月1日起征收航空碳排税以应对冰川融化和全球变暖,使得对如何降低大气中CO2的含量及有效地开发利用碳资源的研究显得更加紧迫。请运用化学反应原理的相关知识研究碳及其化合物的性质。
(1)用电弧法合成的储氢纳米碳管常伴有大量的碳纳米颗粒(杂质),这种颗粒可用如下氧化法提纯,请完成该反应的化学方程式:
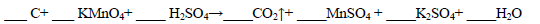
(2)焦炭可用于制取水煤气。测得12 g 碳与水蒸气完全反应生成水煤气时,吸收了131.6 kJ热量。该反应的热化学方程式为 。
(3)活性炭可处理大气污染物NO。在2 L密闭容器中加入NO和活性炭(无杂质),生成气体E和F。当温度分别在T1和T2时,测得各物质平衡时物质的量如下表:
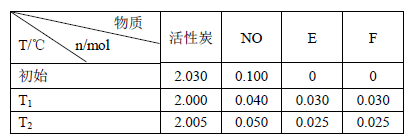
上述反应T1℃时的平衡常数为K1,T2℃时的平衡常数为K2。
Ⅰ.计算K1= 。
Ⅱ.根据上述信息判断,温度T1和T2的关系是(填序号) 。
(4)CO2经常用氢氧化钠来吸收,现有0.4 molCO2,若用200ml 3mol/LNaOH溶液将其完全吸收,溶液中离子浓度由大到小的顺序为: 。
(5)CO还可以用做燃料电池的燃料,某熔融盐燃料电池具有高的发电效率,因而受到重视,该电池用Li2CO3和 Na2CO3的熔融盐混合物作电解质,CO为负极燃气,空气与CO2的混和气为正极助燃气,制得在 650 ℃下工作的燃料电池,其负极反应式: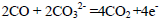 则
则
正极反应式:___ ,电池总反应式 。
参考答案:(1)5、4、6、5、4、2、6(2)C(s)+H2O(g)=CO(g)+H2(g),ΔH=+131.6 kJ?mol—1(3)①Ⅰ.0.5625 Ⅱ.c(4)c(Na+) > c(HCO3-) > c(CO32-) > c(OH-) > c(H+)(5)O2 +2CO2+4e-=2CO32-, 2CO+O2=2CO2
本题解析:(1)反应中C元素的化合价由0升高为+4价,一个碳化合价变化4,Cr元素的化合价由+6价降低为+3价,1个K2Cr2O7化合价变化6,4和6的最小公倍数为12,由化合价升降总数相等可知,C的化学计量数为3,K2Cr2O7的化学计量数为2,由于产物中有Cr2(SO4)3,所以未知的反应物为H2SO4,最后由质量守恒定律可知得化学反应为3C+2K2Cr2O7+8H2SO4
本题难度:困难
2、选择题 水热法制备纳米颗粒Y(化合物)的反应为:3Fe2++2S2O32-+O2+a OH-=Y+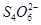 +2H2O下列说法中,不正确的是?(?)
+2H2O下列说法中,不正确的是?(?)
A.S2O32-是还原剂
B.Y的化学式为Fe2O3
C.a=4
D.每有1mol O2参加反应,转移的电于总数为4 mol
参考答案:B
本题解析:根据题意可知:Fe2+和S2O32-作还原剂失去电子。氧气得到电子作氧化剂。每有1mol O2参加反应,转移的电于总数为4 mol结合原子守恒可得Y的化学式为Fe3O4,a=4.选项为 :B。
本题难度:一般
3、选择题 物质的量之比为 2∶5 的锌与稀硝酸反应,若硝被还原的产物为 N2O,反应结束后锌没有剩余,则该反应中被还原的硝酸与未被还原的硝酸的物质的量之比是(?)
A.1:4
B.1:5
C.2:3
D.2:5
参考答案:A
本题解析:锌与稀硝酸反应时硝酸既表现酸性又表现氧化性,根据原子守恒和电子守恒,2mol锌失去4mol电子,生成2mol锌离子,由于生成硝酸锌,则其结合的硝酸根离子是4mol,则剩余的1mol的硝酸被还原为N2O就得到4mol电子,硝酸也全部反应,则该反应中被还原的硝酸与未被还原的硝酸的物质的量之比是1:4,答案选A。
点评:该题是高考中的常见题型,属于中等难度的试题。该题是对硝酸的氧化性知识的考查,答题时注意电子守恒思想在氧化还原反应中的运用,有利于培养学生的逻辑推理能力,有利于提高学生的应试能力和学习效率。
本题难度:一般
4、填空题 六价铬对人体有毒,含铬废水要经过化学处理后才能排放,方法是用绿矾(FeSO4·7H2O)把废水中六价铬还原成三价铬离子,再加入过量的石灰水,使铬离子生成Cr(OH)3沉淀。
(1)配平下列主要反应的化学方程式。
 H2Cr2O7+
H2Cr2O7+ FeSO4+
FeSO4+ H2SO4——
H2SO4—— Fe2(SO4)3+
Fe2(SO4)3+ Cr2(SO4)3+
Cr2(SO4)3+ H2O
H2O
(2)处理后的沉淀中有Cr(OH)3外,还有__________________ (用化学式表示)。
(3)现在处理1×103 L含铬(+6)78 mg·L-1的废水,需要绿矾_________ g。
参考答案:(1)1? 6? 6? 3? 1? 7? (2)Fe(OH)3? (3)1 251
本题解析:本题考查了氧化还原反应方程式的配平和计算。铬元素的化合价由+6降到+3,铁元素的化合价由+2升高到+3,应用得失电子守恒时要特别注意每个H2Cr2O7含有两个铬原子,再应用观察法配平整个化学方程式。
由H2Cr2O7+6FeSO4+6H2SO4====3Fe2(SO4)3+Cr2(SO4)3+7H2O可知:
2Cr—H2Cr2O7—6FeSO4·7H2O
m(FeSO4·7H2O)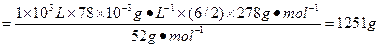
本题难度:一般
5、填空题 (3分)酸性条件下,许多氧化剂可使KI溶液中的I-氧化,例如KIO3(IO3-→I2)、H2O2(H2O2→H2O)、FeCl3(Fe3+→Fe2+)、K2Cr2O7(Cr2O72-→Cr3+)。请根据题目要求填空:
(1)写出在醋酸存在的条件下KIO3溶液与KI溶液反应的离子方程式?。
(2)在酸性条件下(足量),各取1 L浓度为1 mol·L-1的KI溶液分别与上述列举四种溶液进行完全反应,则需要溶质的物质的量之比为n(KIO3):n(H2O2):n(FeCl3):n(K2Cr2O7)="?" :? :? :? .(要求写出最简比)
参考答案:(1)IO3-+5I-+6CH3COOH="3I2+3H2O+6CH3COO-?" (2分)
(2)6:15:30:5?(2分)
本题解析:略
本题难度:一般