微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 已建立平衡的某可逆反应,当改变条件使化学平衡向正反应方向移动时,下列叙述正确的是( )
(1)生成物的体积分数一定增加 ?(2)生成物的产量一定增加
(3)反应物的转化率一定增大 ?(4)反应物浓度一定降低
(5)正反应速率一定大于逆反应速率?(6)加入催化剂可以达到以上目的.
A.(1)(2)
B.(2)(5)
C.(3)(5)
D.(4)(6)
参考答案:B
本题解析:
本题难度:一般
2、选择题 已知反应A2(g)+2B2(g)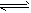 2AB2(g) △H<0,下列说法正确的是
2AB2(g) △H<0,下列说法正确的是
[? ]
A.升高温度有利于反应速率增加,从而缩短达到平衡的时间
B.升高温度,正向反应速率增加,逆向反应速率减小
C.达到平衡后,升高温度或增大压强都有利于该反应平衡正向移动
D.达到平衡后,降低温度或减小压强都有利于该反应平衡正向移动
参考答案:A
本题解析:
本题难度:一般
3、填空题 科学家一直致力于“人工固氮”的新方法研究。
(1)目前合成氨技术原理为:N2(g)?+?3H2(g) 2NH3(g); △H=-92.4kJ·mol-1。
2NH3(g); △H=-92.4kJ·mol-1。
①?673K,30MPa下,上述合成氨反应中n(NH3)和n(H2)随时间变化的关系如图所示。下列叙述正确的是__________。
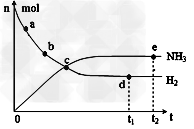
A.点a的正反应速率比点b的大?
B.点c处反应达到平衡
C.点d和点?e处的n(N2)相同
D.773K,30MPa下,反应至t2时刻达到平衡,则n(NH3)比图中e点的值大
②?在容积为2.0?L恒容的密闭容器中充入0.80?mol?N2(g)和1.60?mol?H2(g),反应在673K、30MPa下达到平衡时,NH3的体积分数为20%。该条件下反应N2(g)?+?3H2(g) 2NH3(g)的平衡常数K=?________。(保留小数一位)K值越大,表明反应达到平衡时_________(填标号)。
2NH3(g)的平衡常数K=?________。(保留小数一位)K值越大,表明反应达到平衡时_________(填标号)。
A.H2的转化率一定越高?
B.NH3的产量一定越大
C.正反应进行得越完全?
D.化学反应速率越大
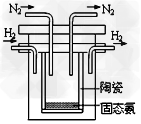
(2)1998年希腊亚里斯多德大学的两位科学家采用高质子导电性的?SCY陶瓷(能传递H+),实现了高温常压下高转化率的电解合成氨。其实验装置如图。阴极的电极反应式
____________________。
(3)根据最新“人工固氮”的研究报道,在常温、常压、光照条件下, N2在催化剂(掺有少量Fe2O3的TiO2)表面与水发生下列反应:N2(g)?+?3H2O(1) 2NH3(g)?+?O2(g)。△H?=?a?kJ·mol-1 进一步研究NH3生成量与温度的关系,常压下达到平衡时测得部分实验数据如下表
2NH3(g)?+?O2(g)。△H?=?a?kJ·mol-1 进一步研究NH3生成量与温度的关系,常压下达到平衡时测得部分实验数据如下表

①此合成反应的a______0;ΔS_______0,(填“>”、“<”或“=”)
②已知:N2(g)?+?3H2(g) 2NH3(g)?ΔH=?-92?.4kJ·mol-1?
2NH3(g)?ΔH=?-92?.4kJ·mol-1?
2H2(g)?+?O2(g)?=?2H2O(l)?=?-571.6kJ·mol-1
则N2(g)?+?3H2O(l)?=?2NH3(g)?+?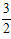 O2(g)?ΔH=_____________kJ·mol-1
O2(g)?ΔH=_____________kJ·mol-1
参考答案:(1)①AC;②1.1;C
(2)N2 + 6 H+ + 6e-= 2NH3
(3)①>;>?;?②+765 kJ·mol-1
本题解析:
本题难度:一般
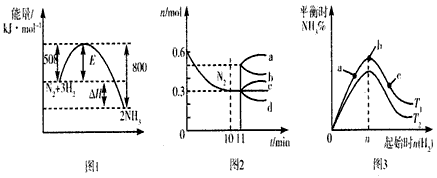
4、选择题 合成氨反应为N2(g) +3H2(g) 2NH3(g)。图1表示在一定温度下反应过程中的能量变化,图2表示在2L密闭容器中反应时N2的物质的量随时间变化的曲线,图3表示在其他条件不变的情况下,改变起始物氢气的物质的量对反应平衡的影响。
2NH3(g)。图1表示在一定温度下反应过程中的能量变化,图2表示在2L密闭容器中反应时N2的物质的量随时间变化的曲线,图3表示在其他条件不变的情况下,改变起始物氢气的物质的量对反应平衡的影响。
下列说法正确的是
[? ]
A.该反应为自发反应,由图1可知加入适当的催化剂,E和△H都减小
B.图2中,0~10min内该反应的平均速率v(H2)=0. 045 mol·L-1·min-1,从11 min起,其他条件不变,压缩容器的体积,使其为1L,则n(N2)的变化曲线为d
C.图3中,a、b、c三点所处的平衡状态中,反应物N2的转化率最高的是b点
D.图3中,T1和T2表示温度,对应温度下的平衡常数为K1和K2,则:T1>T2,K1>K2
参考答案:B
本题解析:
本题难度:一般
5、选择题 在其他条件不变时,研究改变某一条件对A2(g)+3B2(g) 2AB3(g)化学平衡状态的影响,得到如图所示的变化规律(图中T表示温度,n表示物质的量)。据图可得出的判断正确的是
2AB3(g)化学平衡状态的影响,得到如图所示的变化规律(图中T表示温度,n表示物质的量)。据图可得出的判断正确的是

[? ]
A.正反应一定是放热反应
B.达到平衡时A2的转化率大小为a>b>c
C.若T2>T1,则正反应一定是放热反应
D.b点时,平衡体系中A、B原子数之比接近1:3
参考答案:D
本题解析:
本题难度:一般