微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 由镁、铝、铁三种金属单质中的两种组成的混合物共6g,与足量的稀盐酸反应,产生标准状况下的氢气2.8L,由此得出的结论中正确的是
A.混合物中一定含有铝
B.混合物中一定含有铁
C.该混合物一定是由铁和镁组成的
D.混合物中一定不含有铁
参考答案:B
本题解析:分析:根据n= 计算氢气的体积,根据电子转移守恒计算提供1mol电子需要金属的平均质量,计算提供1mol电子需要各金属的质量,根据平均值判断.
计算氢气的体积,根据电子转移守恒计算提供1mol电子需要金属的平均质量,计算提供1mol电子需要各金属的质量,根据平均值判断.
解答:标准状况下,2.8L氢气的物质的量= =0.125mol,
=0.125mol,
根据电子转移守恒可知,6g混合金属提供电子的物质的量为0.125mol×2=0.25mol,
故提供1mol电子需要混合金属的平均质量为6g× =24g,
=24g,
镁与盐酸反应表现+2价,提供1mol电子需要Mg的质量为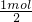 ×24g/mol=12g,
×24g/mol=12g,
铝与盐酸反应表现+3价,提供1mol电子需要Al的质量为 ×27g/mol=9g,
×27g/mol=9g,
铁与盐酸反应表现+2价,提供1mol电子需要Fe的质量为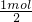 ×56g/mol=28g,
×56g/mol=28g,
Fe提供1mol电子的质量大于24g,Mg、Al提供1mol电子的质量小于24g,故一定含有Fe,Mg、Al至少含有一种,
故选B.
点评:本题考查混合物的有关计算,难度不大,注意利用平均值法与极限法的利用.
本题难度:困难
2、选择题 乙烷受热分解生成乙烯和氢气,现有乙烷部分分解的产物,取1体积使其充分燃烧生成1.6体积的二氧化碳(在相同条件下测定)则乙烷的分解率为
A.20%
B.25%
C.50%
D.75%
参考答案:B
本题解析:分析:乙烷分解的化学方程式为:C2H6→C2H4+H2,根据方程式计算,
解答:由于相同条件下体积之比即为物质的量之比,因而题目中的体积不妨改成物质的量,1mol混合物充分燃烧生成1.6molCO2,
根据碳元素守恒可知:n(C2H6)+n(C2H4)= n(CO2)=
n(CO2)= ×1.6mol=0.8mol,
×1.6mol=0.8mol,
则:n(H2)=1mol-0.8mol=0.2mol
C2H6→C2H4+H2
1? 1
0.2mol? 0.2mol
即有0.2molC2H6分解.
则:乙烷的分解率为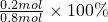 =25%,
=25%,
故选B.
点评:本题考查混合物的计算,涉及乙烷的分解率,题目难度不大,注意由于相同条件下体积之比即为物质的量之比.根据C元素守恒计算.
本题难度:一般
3、选择题 在pH=1的溶液中,可以大量共存的离子组是
A.Na+,K+,S2-,Cl-
B.Al3+,Mg2+,SO42-,Cl-
C.K+,Na+,AlO2-,NO3-
D.K+,Na+,SO42-,S2O32-
参考答案:B
本题解析:分析:pH=1的溶液中有大量的H+,利用离子之间不能结合生成弱电解质、不能结合生成沉淀、不能发生氧化还原反应等来判断离子的共存.
解答:A、pH=1的溶液中有大量的H+,因H+、S2-能结合生成弱电解质,则不能大量共存,故A错误;
B、因该组离子之间不反应,则能够大量共存,故B正确;
C、pH=1的溶液中有大量的H+,因H+、AlO2-能结合生成氢氧化铝沉淀,则不能大量共存,故C错误;
D、pH=1的溶液中有大量的H+,因H+、S2O32-能发生氧化还原反应,则离子之间不能大量共存,故D错误;
故选B.
点评:本题考查离子的共存问题,熟悉常见离子的性质、复分解反应的条件、氧化还原反应是解答本题的关键.
本题难度:一般
4、选择题 下列物质中,既能发生加成反应,也能发生取代反应,并能使KMnO4酸性溶液褪色的是
A.氯仿
B.苯
C.甲苯
D.乙烷
参考答案:C
本题解析:氯仿不能发生加成反应,苯不能使酸性高锰酸钾溶液褪色,乙烷不能发生加成反应,也不能使酸性高锰酸钾溶液褪色,所以答案选C。
本题难度:简单
5、选择题 甲酸甲酯分子内处于不同化学环境的氢原子种数(即核磁共振谱的峰数)为
A.1
B.2
C.3
D.4
参考答案:B
本题解析:甲酸甲酯的结构简式是HCOOCH3,所以分子内处于不同化学环境的氢原子是2类。答案选B。
本题难度:一般