微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 (17分)黄铜矿是工业炼铜的主要原料,其主要成分为CuFeS2,现有一种天然黄铜矿(含少量脉石SiO2),为了测定该黄铜矿的纯度,某同学设计了如下实验:

称取研细的黄铜矿样品1.150g,在空气存在的条件下进行煅烧。实验后取d中溶液的1/10置于锥形瓶中,用0.05mo1/L标准碘溶液进行滴定,初读数为0.10mL,终读数如右上图所示。
(1)黄铜矿煅烧的反应为8CuFeS2+21O2高温8Cu+4FeO+2Fe2O3+16SO2,该反应中被还原的元素是___(填元素符号)。
(2)标准碘溶液应盛放在(填“碱式”或“酸式”)________滴定管中;装液之前,滴定管要用标准碘溶液润洗2—3次,润洗的操作是:?。请用化学方程式表示滴定的原理:?。
(3)滴定终点的读数为?mL;通过计算可知,该黄铜矿的纯度为?。
(4)若去掉c装置,会使测定结果??(填“偏低”“偏高”或“无影响”)。
(5)假设实验操作均正确,测得黄铜矿的纯度偏低,可能的原因主要有?。
参考答案:(17分) (1)Cu、O(2分,各1分)
(2)酸式(2分);往滴定管上口加入3~5mL标准碘溶液,倾斜转动滴定管,使液体润湿全部滴定管内壁,然后,一手控制活塞,将液体从滴定管下部放出(3分,每个要点给1分);
SO2+I2+2H2O=H2SO4+2HI? (或H2SO3+I2+H2O=H2SO4+2HI)(2分,配平错误扣1分)
(3)20.10(2分,数位错的不给分);80.4%(2分)?(4)偏低(2分)
(5)二氧化硫未能被水充分吸收,亚硫酸部分被氧化(2分,各1分)
本题解析:(1)根据方程式可知铜元素的化合价从+2价降低到0价,氧元素的化合价从化0价降低-2价,被还原。硫元素的化合价从-1价升高到+4价,铁元素的化合价从+2价部分升高到+3价,被氧化。
(2)标准碘溶液显酸性应盛放在酸式滴定管中;装液之前,滴定管要用标准碘溶液润洗2—3次,润洗的操作是往滴定管上口加入3~5mL标准碘溶液,倾斜转动滴定管,使液体润湿全部滴定管内壁,然后,一手控制活塞,将液体从滴定管下部放出。SO2检验还原性能被单质碘氧化,则表示滴定原理的方程式为SO2+I2+2H2O=H2SO4+2HI。
(3)滴定管自上而下刻度逐渐增大,且能精确到0.1mol,所以根据装置图可知滴定终点的读数为20.10?mL;因此根据方程式SO2+I2+2H2O=H2SO4+2HI可知消耗SO2的物质的量是0.05mo1/L×0.02010L=0.001005mol,则原矿石中产生的SO2是0.001005mol×10=0.01005mol,所以根据方程式8CuFeS2+21O2高温8Cu+4FeO+2Fe2O3+16SO2可知CuFeS2的物质的量是0.01005mol÷2=0.005025mol,其质量为0.005025mol×184g/mol=0.9246g,则该黄铜矿的纯度为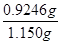 ?×100×=80.4%.
?×100×=80.4%.
(4)铜网的作用是除去未反应的氧气,氧气具有氧化性,如果没有装置c,则导致SO2与碘反应时消耗碘溶液的体积减少,从而导致纯度偏低。
(5)假设实验操作均正确,测得黄铜矿的纯度偏低,这说明消耗的标准液碘的体积偏少,因此可能的原因主要有二氧化硫未能被水充分吸收或亚硫酸部分被氧化。
本题难度:一般
2、选择题 FeS2可在Fe2(SO4)3溶液中“溶解”,硫元素都以SO42-的形式存在。若有l mol FeS2“溶解”,则生成H2SO4的物质的量为
A.2mol
B.4 mol
C.6 mol
D.8 mol
参考答案:D
本题解析:根据信息可书写方程式为8H2O + FeS2 + 7Fe2(SO4)3= 15FeSO4 + 8H2SO4 ,当l mol FeS2反应时,则生成H2SO4的物质的量为8 mol,D正确;
本题难度:一般
3、选择题 Na2FeO4是一种高效多功能水处理剂,一种制备Na2FeO4的方法可用化学方程式表示如下:2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2 +O2↑。下列对此反应的说法中,不正确的是( )
+O2↑。下列对此反应的说法中,不正确的是( )
A.方框中的物质为Na2SO4
B.Na2O2既是氧化剂,又是还原剂
C.Na2FeO4既是氧化产物,又是还原产物
D.2 mol FeSO4发生反应时,反应中共转移8 mol电子
参考答案:D
本题解析:根据元素守恒可知A正确。分析化合价变化可知,2个+2价Fe原子失去8个电子,根据生成物中的“O2”可知在“6Na2O2”中,有2个-1价的氧的化合价升至0价,失去2个电子,另有10个-1价氧的化合价降至-2价,得失电子数均为10个。据此可知B、C均正确。2 mol FeSO4发生反应时,反应中共有10 mol电子发生转移,故D错误。
本题难度:一般
4、填空题 钛及其合金具有密度小,强度高,耐腐蚀等优良性能,被广泛用于航天、航空、航海、石油化工、医药等部门,因此,钛被誉为第三金属和战略金属。从铁钛矿提取金属钛(海绵钛)的主要工艺过程如下:
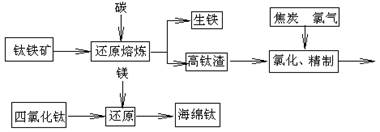
(1)钛铁矿的主要成分是FeTiO3,第一步发生的反应:FeTiO3+C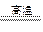 TiO2+Fe+CO↑,在FeTiO3(钛酸亚铁)中,钛的化合价为?。
TiO2+Fe+CO↑,在FeTiO3(钛酸亚铁)中,钛的化合价为?。
(2)第二步:二氧化钛在高温下与焦炭、氯气反应生成四氯化钛和一氧化碳,写出化学方程式:?,还原产物是?。
(3)用镁在高温下还原四氯化钛,该反应的环境要求是?;写出化学方程式?。
(4)菱镁矿(主要成分是碳酸镁)煅烧后与焦炭混合在氯化器中高温下通入氯气生成氯化镁,电解熔融氯化镁得到镁。
①写出菱镁矿煅烧及氯化制取氯化镁的化学方程式:?;
②写出电解熔融氯化镁的电解方程式?。
参考答案:
(1)+4价?(2)TiO2+2C+2Cl2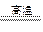 TiCl4+2CO?四氯化钛? (3)惰性气体保护? 2Mg+TiCl4
TiCl4+2CO?四氯化钛? (3)惰性气体保护? 2Mg+TiCl4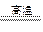 2MgCl2+Ti?
2MgCl2+Ti?
(4)①MgCO3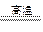 MgO+CO2↑,MgO+Cl2+C
MgO+CO2↑,MgO+Cl2+C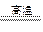 MgCl2+CO;②MgCl2
MgCl2+CO;②MgCl2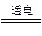 Mg+Cl2↑
Mg+Cl2↑
本题解析:(1)根据钛酸亚铁名称知,铁呈+2价,从反应式看,得失电子总数相等,说明钛化合价没有变,即钛呈+4价。(2)根据反应物和产物写化学方程式,注意配平。(3)高温下镁和钛都易与空气中氧气反应,故要在保护气中还原钛,不能用二氧化碳和氮气作保护气,因为镁能与二氧化碳和氮气反应。用惰性气体作保护气,如氩气等。(4)碳酸镁分解类似碳酸钙,在氯气作用下焦炭还原氧化镁生成氯化镁和一氧化碳。电解熔融氯化镁生成镁和氯气,初中教材中出现了电解水,高中介绍了用电解法冶炼镁、铝、钠等活泼金属。
本题难度:一般
5、选择题 制取漂白液的化学方程式是:Cl2+2NaOH=NaCl+NaClO+H2O,该反应的氧化剂与还
原剂物质的量之比为
A.1:1
B.1:2
C.2:1
D.3:2
参考答案:A
本题解析:略
本题难度:一般