微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 将5.6gFe在一定量稀硝酸中恰好完全溶解后,往溶液中滴加NaOH溶液立即产生沉淀,滴加至沉淀量最大时止,再将所得溶液和沉淀一起加热蒸干并在空气中灼烧至恒重,所得固体成分和质量可能为
A.A
B.B
C.C
D.D
参考答案:AB
本题解析:分析:根据5.6gFe与稀硝酸反应可能生成硝酸亚铁或硝酸铁两种情况计算,5.6gFe的物质的量为0.1mol,加入氢氧化钠后蒸干,得到0.1mol氢氧化铁(氢氧化亚铁会被空气氧化)和0.2mol硝酸钠,或硝酸钠0.3mol,最后得到0.05mol氧化铁和0.2mol硝酸钠或0.3mol亚硝酸钠,可分别计算出亚硝酸钠的质量范围.
解答:如果25.6gFe的物质的量=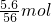 =0.1mol,铁全部恰好生成硝酸亚铁,则硝酸亚铁物质的量为0.1mol,加入氢氧化钠后蒸干,得到0.1mol氢氧化铁(氢氧化亚铁会被空气氧化)和0.2mol硝酸钠,
=0.1mol,铁全部恰好生成硝酸亚铁,则硝酸亚铁物质的量为0.1mol,加入氢氧化钠后蒸干,得到0.1mol氢氧化铁(氢氧化亚铁会被空气氧化)和0.2mol硝酸钠,
根据元素质量守恒可得加热生成0.05mol氧化铁和0.2mol亚硝酸钠,
质量是:氧化铁0.05mol×160g/mol=8g,亚硝酸钠0.2mol×69g/mol=13.8g
如果恰好生成硝酸铁0.1mol,则氧化铁依然是0.05mol,硝酸钠是0.3mol,
灼烧生成氧化铁4g,根据N元素守恒可得亚硝酸钠0.3mol,质量为0.3mol×69g/mol=20.7g
所以氧化铁质量肯定是4g,亚硝酸钠质量应该在[13.8,20.7]区间内,
故选AB.
点评:本题考查混合物的计算,题目难度较大,本题考虑5.6gFe与稀硝酸反应可能生成硝酸亚铁或硝酸铁两种情况计算,利用端值法求解,注意加热氢氧化亚铁时生成氧化铁而不是氧化亚铁,为易错点.
本题难度:简单
2、选择题 下列物质的名称和化学式不相符的是
A.磁铁矿(FeO)
B.铝土矿(Al2O3)
C.铁红(Fe2O3)
D.赤铁矿(Fe2O3)
参考答案:A
本题解析:分析:磁铁矿的主要成分是Fe3O4,Fe2O3俗称铁红,赤铁矿的主要成分是Fe2O3,硫铁矿的主要成分是FeS2,铝土矿的主要成分是Al2O3,其次含有Fe2O3、SiO2等
解答:磁铁矿的主要成分是Fe3O4,故A错误.
故选:A.
点评:本题主要考查各种矿石的主要成分.
本题难度:简单
3、选择题 等质量的铁、锌、铝与足量的稀盐酸反应,生成氢气由多到少的顺序为
A.铁、锌、铝
B.锌、铁、铝
C.铝、铁、锌
D.铝、锌、铁
参考答案:C
本题解析:当等质量的金属与足量酸反应时,金属的相对原子质量与其化合价的比值越小生成的氢气越多。比值分别为:Fe:56/2=28,Zn: 65/2=32.5, Al:27/3=9 。大小关系一目了然,故正确答案为C。
本题难度:困难
4、选择题 铝制器皿能够盛放的物质是
A.KOH溶液
B.浓硫酸
C.NaOH溶液
D.稀硫酸
参考答案:B
本题解析:试题分析:铝能和氢氧化钠、氢氧化钾溶液以及稀硫酸反应,不能用来盛放。在常温下,铝在浓硫酸中发生钝化,可以盛放,答案选B。
考点:考查铝的性质
点评:该题是高考中的常见题型,属于基础性试题的考查。该题的关键是记住单质铝的化学性质,然后灵活运用即可。
本题难度:简单
5、选择题 在Na2SO4和Al2(SO4)3的混合溶液中,如果[SO42-]=0.3mol?L-1,当加入等体积的0.2mol/L的NaOH溶液时,生成沉淀恰好完全溶解,则原混合溶液中Na+?物质的量浓度是
A.0.5?mol/L
B.0.3?mol/L
C.0.45?mol/L
D.0.225?mol/L
参考答案:C
本题解析:分析:当加入等体积的0.2mol/L的NaOH溶液时,生成沉淀恰好完全溶解,发生总反应为Al3++4OH-=AlO2-+2H2O,令溶液体积为1L,根据反应据此计算溶液中Al3+的物质的量,根据c= 计算原溶液中Al3+的浓度,根据溶液中电荷守恒有c(Na+)+3c(Al3+)=2c(SO42-),据此计算原溶液中Na+?物质的量浓度.
计算原溶液中Al3+的浓度,根据溶液中电荷守恒有c(Na+)+3c(Al3+)=2c(SO42-),据此计算原溶液中Na+?物质的量浓度.
解答:令溶液体积为1L,则氢氧化钠的物质的量为1L×0.2mol/L=0.2mol,根据反应Al3++4OH-=AlO2-+2H2O可知,原溶液中Al3+的物质的量为0.2mol×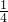 =0.05mol,原溶液中Al3+的浓度为
=0.05mol,原溶液中Al3+的浓度为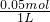 =0.05mol/L,
=0.05mol/L,
根据溶液中电荷守恒有c(Na+)+3c(Al3+)=2c(SO42-),
故c(Na+)=2c(SO42-)-3c(Al3+)=0.3mol/L×2-0.05mol/L×3=0.45mol/L,
故选C.
点评:考查溶液中离子浓度的计算等,难度不大,混合溶液中有关离子浓度的计算经常利用电荷守恒,注意守恒思想的运用.
本题难度:困难