微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 2005年我国成功发射“神州”六号载人飞船,标志着我国航天技术走在了世界前列。肼(N2H4)是发射航天飞船常用的高能燃料。在火箭推进器中分别装有肼和过氧化氢,当它们混合时即产生气体,并放出大量的热。已知12.8g液态肼与足量过氧化氢反应生成氮气和水蒸气,放出256.65kJ的热量;1mol液态水变成1mol水蒸气需要吸收44kJ的热量。写出液态肼与过氧化氢反应生成液态水的热化学方程式____________________。
参考答案:N2H4(l)+2H2O2(l)=N2(g)+4H2O(l) △H=-817.625kJ/mol
本题解析:
本题难度:一般
2、填空题 (1)在25℃、101kPa下, 1g甲烷完全燃烧生成CO2和液态H2O,放出55 kJ的热量,写出表示甲烷燃烧热的热化学方程式: 。
(2)2Zn(s)+O2(g)=2ZnO(s) ΔH1 =" —702" kJ/mol
2Hg(l)+O2(g)=2HgO(s) ΔH2 =" —182" kJ/mol
由此可知ZnO(s)+Hg(l)= Zn(s)+HgO(s)△H3=  。
。
(3)已知 2SO2(g)+O2(g) =2SO3(g)反应过程的能量变化如图所示。已知1mol SO2(g)氧化为1mol SO3的 ΔH=—99kJ·mol-1.请回答下列问题:
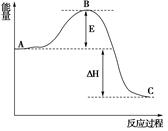
①图中A、C分别表示 、 ,
②E的大小对该反应的反应热有无影响? 。该反应通常用V2O5作催化剂,加V2O5会使图中B点升高还是降低? ,理由是
③图中△H= kJ·mol-1。
参考答案:(1)CH4(g)+2O2(g)===CO2(g)+ 2H2O(g) ΔH="-880" kJ/mol
( 2)+260 kJ/mol
2)+260 kJ/mol
(3)①反应物能量 生成物能量
②无 降低 因为催化剂改变了反应的历程使活化能E降低
③-198
本题解析:略
本题难度:简单
3、选择题 下列热化学方程式中,△H能表示对应物质的标准燃烧热的是( ? )
A.2C8H18O(l)+25O2(g)═16CO2(g)+18H2O(l)△H=-11828.0?kJ?mol-1
B.CO(g)+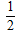 O2(g)═CO2(g)△H=-283.0?kJ?mol-1
O2(g)═CO2(g)△H=-283.0?kJ?mol-1
C.C(s)+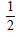 O2(g)═CO(g)△H=-110.5?kJ?mol-1
O2(g)═CO(g)△H=-110.5?kJ?mol-1
D.H2(g)+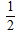 O2(g)═H2O(g)△H=-241.8?kJ?mol-1
O2(g)═H2O(g)△H=-241.8?kJ?mol-1
参考答案:B
本题解析:
本题难度:简单
4、填空题 (14分)燃煤和汽车尾气是造成空气污染产生雾霾的原因之一。消除汽车尾气是减少城市空气污染的热点研究课题。
(1)已知:①N2(g)+O2(g)=2NO(g) △H=+180.5kJ·mol-1
②CO(g)+1/2 O2(g)=CO2 (g) △H=-283kJ·mol-1
则汽车尾气中NO和CO在催化转化器中相互反应成无污染的气体的热化学方程式是_______________。
(2)在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线,如图所示。
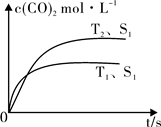
已知当固体催化剂的质量一定时,增大其表面积可提高化学反应速率。若催化剂的表面积S1>S2,在上图中画出c(CO2)在T2、S2条件下达到平衡过程中的变化曲线。
(3)在一定温度下,将2.0mol NO、2.4mol气体CO通入到固定容积为2L的容器中,反应过程中部分物质的浓度变化如图所示:

①有害气体NO的转化率为__________,0~15min NO的平均速率v(NO)=__________mol/(L·min)。(保留两位有效数字)
②20min时,若改变反应条件,导致CO浓度减小,则改变的条件可能是________(选填序号)。
a.缩小容器体积 b.增加CO的量
c.降低温度 d.扩大容器体积
③若保持反应体系的温度不变,20min时再向容器中充入NO、N2各0.4mol,化学平衡将______移动(选填“向左”、“向右”或“不”),移动后在达到平衡时的平衡常数的值是_______(保留两位有效数字)。
(4)汽车尾气中的SO2和过氧化氢可设计成酸性原电池,请写出它的正极反应的方程式__________。
参考答案:(1)2NO(g)+2CO(g)=N2(g)+2CO2(g)) △H=-746.5kJ·mol-1;(2)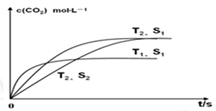
(3)①40% , 0.027;②c d;③向左,0.14 ;(4)H2O2+2e-+2H+=2H2O。
本题解析:(1)NO和CO转化成无污染的气体N2和CO2,②×2-①得出:2CO(g)+2CO(g)=N2(G)+2CO2(g) △H=-283×2-180.5kJ·mol-1=-746.5kJ·mol-1;(2)根据题意增大固体表面积可提高化学反应速率,S1>S2,在温度相同的情况下S1反应速率快达到平衡所用的时间短,图像:
 ;
;
(3)①消耗的n(CO)=(1.2-0.8)×2mol=0.4mol,根据反应方程式消耗的n(CO)和消耗的n(NO)是相等的,即消耗n(NO)=0.8mol,NO的转化0.8/2×100%=40%,0~15minNO的反应速率:v(NO)=0.8/(2×15)mol/(L·min)=0.027)mol/(L·min);②a、减小容器的体积,虽然平衡右移,但各组分的的浓度是增加的,错误;b、增加CO的量,CO的浓度增大,错误;c、此反应是放热反应,降低温度,平衡右移,CO的浓度减少,正确;d、增大容器的体积,虽然平衡左移,但各组分的浓度减小,正确,选项cd正确;③15min的平衡常数K=[c(N2)×c2(CO2)]/[c2(NO)×c2(CO)]=(0.2×0.42)/(0.82×0.62]=0.14,温度不变平衡常数不变,20min后再次达到化学平衡的平衡常数仍为0.14,K=[c(N2)×c2(CO2)]/[c2(NO)×c2(CO)]=(0.4×0.42)/(0.82×0.82]=0.16>0.14,化学平衡向左移动;(4)根据原电池的工作原理,正极上发生还原反应化合价降低,SO2具有还原性,H2O2具有氧化性,因此过氧化氢在正极上得电子,H2O2中的O是-1价变成0价,得到2mole-,根据反应前后所带电荷数相等,推出有H+参加反应,即H2O2+2H++2e-=2H2O。
考点:考查反应热的计算、化学平衡及化学平衡常数的计算、电极反应式的书写等知识。
本题难度:困难
5、选择题 下列热化学方程式书写正确的是(的绝对值均正确)
[? ]
A.C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(g);△H=-1367.0 kJ/mol(燃烧热)
B.NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l);△H=+57.3kJ/mol(中和热)
C.S(s)+O2(g)=SO2(g);△H=-269.8kJ/mol(反应热)
D.2NO2=O2+2NO;△H=+116.2kJ/mol(反应热)
参考答案:C
本题解析:
本题难度:简单