微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
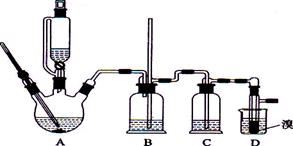
1、实验题 实验室用少量的溴水和足量的乙醇制备1,2—二溴乙烷的装置如下图所示:
有关数据列表如下:
?
| 乙醇
| 1,2-二溴乙烷
| ?乙醚
|
状态
| 无色液体
| ?无色液体
| ?无色液体
|
密度/g · cm-3
| ? 0.79
| ? 2.2
| ? 0.71
|
沸点/℃
| ? 78.5
| ? 132
| ? 34.6
|
熔点/℃
| ? -l30
| ? 9
| ? -1l6
|
?
回答下列问题:
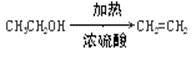
(1)烧瓶D中发生的主要的反应方程式?。
(2)安全瓶B可以防倒吸,并可以检查实验进行时试管D是否发生堵塞。请写出发生堵塞时瓶B中的现象?。
(3)在装置C中应加入??(填字母) ,其目的是_______________。
a.水?b.浓硫酸? c.氢氧化钠溶液
(4)若产物中有少量未反应的Br2,最好用?洗涤除去。(填字母)
a.水?b.氢氧化钠溶液?c.碘化钠溶液?d.乙醇
采取分离的主要玻璃仪器是?;
(5)若产物中有少量副产物乙醚,可用?的方法除去。
(6)反应过程中应用冷水冷却装置D,但又不能过度冷却(如用冰水),其原因是?。
(7)判断该制各反应已经结束的最简单方法是?;
参考答案:(1)CH2=CH2+Br2→CH2Br-CH2Br
(2)B中广口瓶中液面下降,导管中水面上升
(3)c?除去可能产生的酸性气体SO2、CO2
(4)b?分液漏斗
(5)蒸馏或分蒸;
(6)溴在常温下,易挥发,乙烯与溴反应时放热,溴更易挥发,冷却可避免溴的大量挥发,但1,2-二溴乙烷的凝固点9℃较低,不能过度冷却;
(7)乙烯和溴水发生加成反应生成1,2-二溴乙烷,1,2-二溴乙烷为无色,所以判断反应结束的方法是观察溴的颜色完全褪去。
本题解析:A装置是制取乙烯,B是安全瓶,C是除排除干扰装置,D是制取1,2-二溴乙烷装置。所以:
(1)D是发生的反应是CH2=CH2+Br2→CH2Br-CH2Br。
(2)如果D中发生堵塞,则B中会发生的现象是,广口瓶中液面下降,导管中水面上升;
(3)浓硫酸具有强氧化性,将乙醇氧化成二氧化碳,自身被还原成二氧化硫,二氧化碳、二氧化硫能和氢氧化钠溶液反应,因此,C中加入的是氢氧化钠溶液,其作用是除去可能产生的酸性气体SO2、CO2。
(4)因Br2能与NaOH溶液反应,且1,2-二溴乙烷与水互不相溶,所以用氢氧化钠溶液吸收Br2,采用的仪器是分液漏斗。
(5)乙醚与其它有机物溶且沸点相关比较大,采用分馏的方法分离。
(6)溴在常温下,易挥发,乙烯与溴反应时放热,溴更易挥发,冷却可避免溴的大量挥发,但1,2-二溴乙烷的凝固点9℃较低,不能过度冷却;
(7)乙烯和溴水发生加成反应生成1,2-二溴乙烷,1,2-二溴乙烷为无色,所以判断反应结束的方法是观察溴的颜色完全褪去。
本题难度:一般
2、选择题 能用分液漏斗分离的一组混合物是
A.硝基苯和酒精
B.溴苯和溴
C.甲苯和四氯化碳
D.硝基苯和水
参考答案:D
本题解析:只有互不相溶的液体之间才能用分液漏斗进行分离,据此可知,选项D正确。其余选项都是易溶或互溶的,答案选D。
点评:该题的高考中的常见题型,属于基础性试题的考查。试题基础性强,主要是考查学生对分液漏斗进行物质分离原理的熟悉掌握程度,有利于培养学生的实验能力。
本题难度:简单
3、选择题 选用一种试剂,将浓度相同的Na2SO3、Na2SO4、Na2CO3、Na2S、BaCl2溶液加以鉴别,这种试剂是(?)
A.CaCl2溶液
B.AgNO3溶液
C.NaOH溶液
D.稀H2SO4
参考答案:D
本题解析:略
本题难度:简单
4、填空题 (10分)可用于分离或提纯物质的方法有:①过滤 ②蒸馏 ③加热分液(填序号)
(1)除去石灰水中悬浮的CaCO3颗粒?
(2)除去NaCl晶体中混有的碘单质?
(3)分离石油中各不同沸点范围的成分?
(4)分离水和苯的混合物?
(5)分离CCl4(沸点76.75℃)和甲苯(沸点110.6℃)____________。
参考答案:⑴? ①?; ⑵? ③?; ⑶? ②?; ⑷? ④?; ⑸? ②?;
本题解析:萃取分液法用来分离在不同溶剂中的溶解度不同的物质,加热分解法用来分离加热易分解的物质,结晶法用来分离温度变化时溶解度变化相差较大的可溶物,分液法用来分离互不相溶的液体物质,蒸馏法用来分离沸点不同的物质,过滤法用来分离固液混合物。
(1)除去石灰水中悬浮的CaCO3颗粒,根据CaCO3的溶解性,是不溶于水的物质,要和石灰水分离,可以采用过滤的方法,所以本题答案为:①;
(2)除去氯化钠中混有的碘单质,根据碘的性质,是一种受热易升华的物质,而加热对氯化钠没有影响,所以本题的答案为:③;
(4)水和苯互不相溶,可用分液的方法分离,故答案为:④;
(5)四氯化碳与甲苯的沸点不同,可用蒸馏的方法分离,故答案为:②。
点评:本题考查物质的分离,题目难度不大,要明确各种分离的方法及其适用范围,做题时注意把握物质的性质和分离的原理。
本题难度:一般
5、填空题 实验室模拟合成氨和氨催化氧化的流程如下:


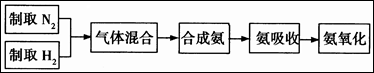
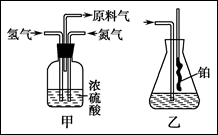
已知实验室可用饱和亚硝酸钠(NaNO2)溶液与饱和氯化铵溶液经加热后反应制取氮气。
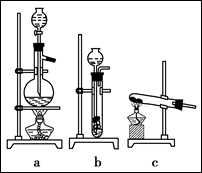
(1)从上图中选择制取气体的合适装置:
氮气?、氢气?。
(2)氮气和氢气通过甲装置,甲装置的作用除了将气体混合外,还有?、?。
(3)氨合成器出来经冷却的气体连续通入乙装置的水中吸收氨,?(填“会”或“不会”)发生倒吸,原因是:?。
(4)用乙装置吸收一段时间氨后,再通入空气,同时将经加热的铂丝插入乙装置的锥形瓶内,能使铂丝保持红热的原因是:?,锥形瓶中还可观察到的现象是:?。
(5)写出乙装置中氨氧化的化学方程式:?。
(6)反应结束后锥形瓶内的溶液中含有H+、OH-、?、?离子。
(B)某课外研究小组,用含有较多杂质的铜粉,通过不同的化学反应制取胆矾。其设计的实验过程为:

(1)杂铜中含有大量的有机物,可采用灼烧的方法除去有机物,灼烧时将瓷坩埚置于
?上(用以下所给仪器的编号填入,下同),取用坩埚应使用?,灼烧后的坩埚应放在?上,不能直接放在桌面上。
实验所用仪器:A.蒸发皿? B.石棉网? C.泥三角? D.表面皿? E.坩埚钳? F.试管夹
(2)杂铜经灼烧后得到的产物是氧化铜及少量铜的混合物,用以制取胆矾。灼烧后含有少量铜的可能原因是?。
A.灼烧过程中部分氧化铜被还原? B.灼烧不充分铜未被完全氧化
C.氧化铜在加热过程中分解生成铜? D.该条件下铜无法被氧气氧化
(3)通过途径Ⅱ实现用粗制氧化铜制取胆矾,必须进行的实验操作步骤:酸溶、加热通氧气、过滤、?、冷却结晶、?、自然干燥。
(4)由粗制氧化铜通过两种途径制取胆矾,与途径Ⅰ相比,途径Ⅱ有明显的两个优点是:?、?。
(5)在测定所得胆矾(CuSO4·xH2O)中结晶水x值的实验过程中:称量操作至少进行
?次。
(6)若测定结果x值偏高,可能的原因是?。
a.加热温度过高? b.胆矾晶体的颗粒较大
c.加热后放在空气中冷却? d.胆矾晶体部分风化
参考答案:(A)(1)a、b?(2)干燥气体?控制氢气和氮气的流速


(3)不会?因为混合气体中含有大量难溶于水的氮、氢两种气体
(4)说明氨的氧化反应是一个放热反应?有红棕色气体产生
(5)4NH3+5O2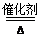 4NO+6H2O
4NO+6H2O
(6)NH ? NO
? NO
(B)(1)C? E? B
(2)A? B?(3)蒸发?过滤?
(4)产生等量胆矾途径Ⅱ消耗硫酸少?途径Ⅱ不会产生污染大气的气体
(5)4?(6)a
本题解析:(A)(1)由题给反应物的状态,NaNO2和NH4Cl都是饱和溶液,可推知N2用a装置,而H2是由锌粒(固)和稀酸(液)来制取,则可用b制取。
(2)干燥气体和调节(或控制)H2和N2的流速。
(3)不会,因合成氨的反应是一个可逆反应,生成的混合气体除NH3以外还有大量的N2和H2存在。
(4)从能使铂丝保持红热可以推知,氨的氧化反应是一个放热反应。根据氨氧化的产物看有NO生成,NO被O2氧化又产生NO2,所以锥形瓶中会看到有红棕色气体产生。
(5)乙装置中氨氧化的反应方程式为4NH3+5O2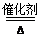 4NO+6H2O。
4NO+6H2O。
(6)因氨氧化生成的NO与O2、H2O反应生成HNO3,未氧化的氨与HNO3反应生成NH4NO3。因此,反应结束后,锥形瓶内的溶液中除有H+、OH-外,还应有NH 和NO
和NO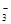 。
。
(B)(1)因坩埚加热后温度较高,应放在泥三角上进行加热,且取用坩埚时要用坩埚钳,并且为防止坩埚炸裂和烧坏桌面,烧后的坩埚要在石棉网上冷却,不能直接放在桌面上。
(2)灼烧后含有少量铜其原因可能是灼热不充分,铜未被完全氧化,也可能是灼烧过程中部分氧化铜被还原。


(3)利用途径Ⅱ制取胆矾时,必须先加酸将氧化铜溶解,加热通氧气将Cu氧化,过滤除去粗制氧化铜中的不溶物杂质后,然后再蒸发溶剂,冷却结晶,再过滤得晶体,最后将其干燥,由此可写出答案。
(4)根据途径Ⅰ的反应方程式Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O和途径Ⅱ的反应方程式2Cu+O2+2H2SO4(稀)
CuSO4+SO2↑+2H2O和途径Ⅱ的反应方程式2Cu+O2+2H2SO4(稀) ?2CuSO4+2H2O,可以看出途径Ⅱ的优点是:①产生等量的胆矾比途径Ⅰ耗硫酸少;②途径Ⅱ不产生污染大气的气体(SO2)。
?2CuSO4+2H2O,可以看出途径Ⅱ的优点是:①产生等量的胆矾比途径Ⅰ耗硫酸少;②途径Ⅱ不产生污染大气的气体(SO2)。
(5)称量操作至少进行4次,分别是:①称量坩埚;②称量加入晶体后的坩埚;③称量加热冷却后的坩埚;
④称量再加热、再冷却后的坩埚至两次称量的值相差不超过0.1 g。
(6)若测定结果x值偏高,可能是加热温度过高使CuSO4晶体中的CuSO4分解了,其他三项均使x值偏低。
本题难度:一般