微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列气体有色、有毒的是
A.Cl2
B.CO
C.N2
D.CO2
参考答案:A
本题解析:有毒的气体是Cl2和CO,Cl2为黄绿色,CO无色.
本题难度:困难
2、选择题 检验二氧化硫中是否含有二氧化碳应采用的方法是
A.通过石灰水
B.先通过高锰酸钾溶液(酸性),再通过石灰水
C.通过品红溶液
D.先通过小苏打溶液,再通过石灰水
参考答案:B
本题解析:
本题难度:困难
3、选择题 下表给出了X、Y、Z、W四种短周期元素的部分信息,请根据这些信息判断下列说法中正确的是?
A.HW水溶液可以保存在玻璃瓶中
B.X的单质与Z的单质反应生成XZ3
C.Z的最高正价为+6
D.原子序数X>Y>W>Z
参考答案:D
本题解析:试题分析:由题目,可以知道X、Y、Z、W分别为S、Mg、O、F;A中,HW为HF,其水溶液能够与玻璃反应,所以A错误;B中,X的单质与Z的单质反应生成XZ2,故B错误;C中,Z的最高正价为0,C也错误,原子序数X>Y>W>Z,所以D正确。
考点:元素的性质
点评:本题考查了元素周期表中元素性质的比较和递变,属于高考的基础考点,本题比较容易。
本题难度:简单
4、选择题 有一无色透明溶液,可能含有K+,Al3+,Mg2+,Fe2+,NH4+,Cl-,SO42-,HCO3-↑中的几种,取该溶液三份分别进行实验:①滴加甲基橙溶液显红色.②逐渐加入NaOH溶液,产生白色沉淀,最后白色沉淀部分溶解.③加入5mL?0.1mol/LBaCl2溶液至不再产生白色沉淀,取上层清液加入足量AgNO3溶液,得到0.2g沉淀.由此推知,原溶液中
A.一定有Al3+,Mg2+,Cl-,SO42-,
B.一定没有 Mg2+,Fe2+,HCO3-
C.不能确定是否含有Cl-
D.可能有K+,NH4+,Cl-,
参考答案:A
本题解析:分析:酸能使甲基橙溶液显红色,铝离子和NaOH溶液反应先产生白色沉淀,然后白色沉淀能完全溶解,氢氧化镁沉淀不溶于氢氧化钠溶液中,硫酸钡为白色沉淀,银离子和氯离子反应生成白色沉淀氯化银.
解答:滴加甲基橙溶液显红色,说明溶液显酸性,所以一定不存在HCO3-,逐渐加入NaOH溶液,产生白色沉淀,最后白色沉淀部分溶解,说明一定同时存在镁离子和铝离子,加入5mL?0.1mol/LBaCl2溶液至不再产生白色沉淀,说明一定存在SO42-,取上层清液加入足量AgNO3溶液,得到沉淀,AgCl的物质的量为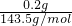 =0.0014mol,5mL0.1mol/LBaCl2溶液中氯离子的物质的量为0.001mol,则原溶液中一定存在氯离子,故选A.
=0.0014mol,5mL0.1mol/LBaCl2溶液中氯离子的物质的量为0.001mol,则原溶液中一定存在氯离子,故选A.
点评:本题考查学生常见离子的检验方法,可以根据所学的知识来回答,难度不大.
本题难度:一般
5、选择题 已知硫酸溶液的密度随浓度增大而增大,若将质量分数分别为20%与50%的硫酸溶液等体积混和,则所得混合溶液的质量分数
A.35%
B.<35%
C.>35%
D.无法确定
参考答案:C
本题解析:分析:令质量分数分别为20%与50%的硫酸溶液的密度分别为xg/ml、yg/ml;硫酸溶液的密度随浓度增大而增大,所以x<y.假定体积为1ml,混合后溶质质量为混合前两溶液中溶质质量之和,混合后溶液质量为混合前溶液质量之和,根据质量分数定义用x、y表示出混合后的质量分数,结合密度关系判断.
解答:令质量分数分别为20%与50%的硫酸溶液的密度分别为xg/ml、yg/ml;硫酸溶液的密度随浓度增大而增大,所以x<y.
假定体积为1ml,则20%硫酸溶液的质量为1ml×xg/ml=xg,溶质硫酸的质量为xg×20%=20%xg.
50%的硫酸溶液的质量为1ml×yg/ml=yg,溶质硫酸的质量为yg×50%=50%yg.
所以混合后硫酸的质量分数为 =
=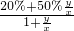 =
=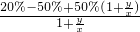 =50%-30
=50%-30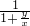 .
.
由于x<y,所以 >1,所以50%-30
>1,所以50%-30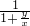 >35%.
>35%.
故选:C.
点评:本题考查溶液浓度的计算和大小比较,题目难度较大,注意硫酸的浓度越大密度越大.
本题难度:一般