微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 在体积一定的密闭容器中给定物质A、B、C的量,在一定条件下发生反应建立的化学平衡:
aA(g)+bB(g)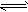 xC(g),符合下图所示的关系(c%表示平衡混合气中产物C的百分含量,T表示温度,p表示压强)。在图中,Y轴是指
xC(g),符合下图所示的关系(c%表示平衡混合气中产物C的百分含量,T表示温度,p表示压强)。在图中,Y轴是指
[? ]
A.反应物A的百分含量
B.平衡混合气中物质B的百分含量
C.平衡混合气的密度
D.平衡混合气的平均摩尔质量
参考答案:D
本题解析:
本题难度:一般
2、选择题 一定条件下,可逆反应2A?

B+3C,在下列四种状态中处于平衡的是( )

A.A
B.B
C.C
D.D
参考答案:化学反应到达平衡时,同一物质的正逆反应速率相等.
A、A物质的正逆反应速率相等,所以该反应达到平衡状态,故A正确.
B、同一反应中,各物质的反应速率之比等于计量数之比,C物质的逆反应速率是2mol/(L.min),A的逆反应速率为43mol/(L.min),A的正反应速率为2mol/(L.min),所以A的正逆反应速率不等,故B错误.
C、同一反应中,各物质的反应速率之比等于计量数之比,B物质的逆反应速率是2 mol/(L.min),A的逆反应速率为4mol/(L.min),A的正反应速率为1mol/(L.min),所以A的正逆反应速率不等,故C错误.
D、同一反应中,各物质的反应速率之比等于计量数之比,C物质的逆反应速率是1.5 mol/(L.min),A的逆反应速率为1mol/(L.min),A的正反应速率为1mol/(L.min),所以A的正逆反应速率相等,故D正确.
故选AD.
本题解析:
本题难度:简单
3、填空题 在密闭容器中,由一定起始浓度的氙(Xe)和F2反应,可得到3种氟化物。各种生成物在平衡体系内分压与反应温度的关系如下图所示(已知气体的分压之比等于物质的量之比)。
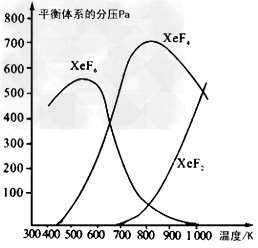
(1)420K时,发生反应的化学方程式为_______________________。若反应中消耗1?mol Xe,则转移电子_______mol。
(2)600K~800K时,会发生反应:XeF6(g) XeF4(g)+?F2(g),其反应热△H ____(填“>”“=”或“<”)0。理由是______________________。
XeF4(g)+?F2(g),其反应热△H ____(填“>”“=”或“<”)0。理由是______________________。
(3)900K时,容器中存在的组分有__________。
参考答案:(1)Xe?+3F2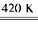 XeF6;6?
XeF6;6?
(2)>;由图可知升高温度XeF6减少,XeF4增多,说明平衡向右移动,所以正反应是吸热反应?
(3)?XeF4、XeF6、XeF2、Xe、F2
本题解析:
本题难度:一般
4、简答题 可逆反应达到平衡的标志是正反应速率与逆反应速率相等反应就停止了.______.
参考答案:可逆反应达到平衡状态时,正逆反应速率相等但不等于零,它是一个动态平衡,所以说法错误,
故答案为:说法错误.
本题解析:
本题难度:一般
5、填空题 (14分)合成氨是人类科学技术上的一项重大突破。
(1)NH3经一系列反应可以得到HNO3和NH4NO3。
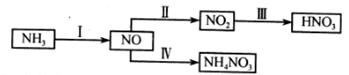
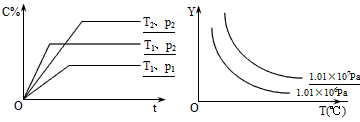
II中,2NO(g)+O2(g) 2NO2(g)。在其他条件相同时,分别测得NO的平衡转化率在不同压强(P1、P2)下随温度变化的曲线如下图)。
2NO2(g)。在其他条件相同时,分别测得NO的平衡转化率在不同压强(P1、P2)下随温度变化的曲线如下图)。
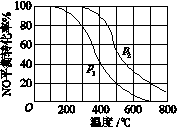
①随温度升高,该反应平衡向__________(选填“正反应”或“逆反应”)方向移动。
②比较P1、P2的大小关系:______________。
(2)一种工业合成氨的简易流程图如下:
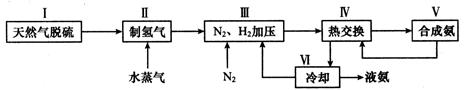
步骤II中制氢气原理如下:
a.CH4(g)+H2O(g) CO(g)+3H2(g) △H =" +206.4" kJ/mol
CO(g)+3H2(g) △H =" +206.4" kJ/mol
b.CO(g)+H2O(g) CO2(g)+H2(g) △H =" —41.2" kJ/mol
CO2(g)+H2(g) △H =" —41.2" kJ/mol
①对于反应a而言,增大CH4的浓度,达新平衡时H2的体积分数_ _ __增大(选填“一定”或“不一定”)。
②利用反应b,将CO进一步转化,可提高H2产量。若在500 ℃时,把等浓度的CO和H2O(g)充入反应容器,达到平衡时c(CO)=0.005 mol·L-1、c(H2)=0.015 mol·L-1,则CO的平衡转化率为 。
③上述流程图中,使合成氨放出的热量得到充分利用的主要步骤是(填序号) ,④简述一种本流程中可以提高合成氨原料总转化率的方法 。
参考答案:19.(14分)(1)①逆反应 ②P2>P1 (2)①不一定 ②3/4或75% (3分)
③Ⅳ ④对原料气加压(或分离液氨后,未反应的N2、H2循环使用 )(3分)
本题解析:(1)①由图像可知,随温度升高,NO的平衡转化率降低,说明该反应平衡向逆反应方向移动,2NO(g)+O2(g) 2NO2(g),增大压强,平衡正向移动,NO的平衡转化率升高,所以P2>P1;
2NO2(g),增大压强,平衡正向移动,NO的平衡转化率升高,所以P2>P1;
(2)①CH4(g)+H2O(g) CO(g)+3H2(g) △H =" +206.4" kJ/mol增大CH4的浓度,达新平衡时H2的体积分数不一定增大,②设CO的转化量为x CO + H2O
CO(g)+3H2(g) △H =" +206.4" kJ/mol增大CH4的浓度,达新平衡时H2的体积分数不一定增大,②设CO的转化量为x CO + H2O CO2 + H2
CO2 + H2
开始量(mol)0.02
转化量(mol) x x x x
平衡量(mol)0.005 0.015 0.015
可得CO转化率=0.015mol÷0.02mol×100%=75%
③上述流程图中,使合成氨放出的热量得到充分利用的主要步骤是Ⅳ;④提高合成氨原料总转化率方法是使合成氨平衡正向移动,所以对原料气加压或分离液氨后,未反应的N2、H2循环使用 。
考点:考查合成氨的工艺流程。
本题难度:困难