微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (4分)某温度时,在2L容器中X、Y、Z三种物质随时间的变化关系曲线如图所示。
(1)由图中的数据分析,该反应的化学方程式为?
(2)反应开始至2min、5minZ的平均反应速率为?、?;
(3)5min后Z的生成速率比5min末Z的生成速率?(大、小、相等)。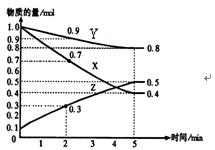
参考答案:(1)3X+Y 2Z
2Z
(2)0.05 mol·(L·min)-1;0.04 mol·(L·min)-1
(3)相等。(每空各1分)
本题解析:略
本题难度:简单
2、填空题 对氮及其化合物的研究具有重要意义。
(1)在1 L密闭容器中,4 mol氨气在一定条件下分解生成氮气和氢气。2 min时反应吸收热量为46.1 kJ,此时氨气的转化率为25%。该反应的热化学方程式为_____________,这段时间内v(H2)=_________。
(2)298K时.在2L固定体积的密闭容器中,发生可逆反应:2NO2(g) N2O4(g)
N2O4(g) 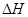 =-akJ·mol-1(a>0),N2O4的物质的量浓度随时间变化如图所示。达平衡时,N2O4的浓度为NO2的2倍。
=-akJ·mol-1(a>0),N2O4的物质的量浓度随时间变化如图所示。达平衡时,N2O4的浓度为NO2的2倍。
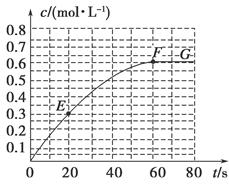
①298K时,该反应的化学平衡常数为_________(精确到0.01);
②下列情况不是处于平衡状态的是__________(填字母序号);
a.混合气体的密度保持不变
b.混合气体的颜色不再变化
c.气压恒定时
③若反应在398K进行,某时刻测得n(NO2)=0.6 mol,n(N2O4)=1.2 mol,则此时v正____v逆(填“>”、“<”或“=”)。
(3)用氨气可设计成如图所示燃料电池,产生的X气体可直接排放到大气中。则a电极电极反应式为________________。
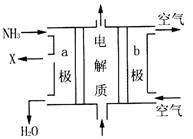
(4)t℃下,某研究人员测定NH3·H2O的电离常数为1.8×10-5。NH4+的水解常数为1.5×10-8,则该温度下水的离子积常数为___________,请判断t_____25℃(填“>”、“<”或“=”)。
参考答案:(1)2NH3(g)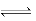 N2(g)+3H2(g) △H=+92.2kJ·mol-1;0.75mol·L-1·min-1;(2)①6.67②a③<;(3)2NH3+6OH--6e-=N2+6H2O;(3)2.7×10-13,>。
N2(g)+3H2(g) △H=+92.2kJ·mol-1;0.75mol·L-1·min-1;(2)①6.67②a③<;(3)2NH3+6OH--6e-=N2+6H2O;(3)2.7×10-13,>。
本题解析:(1)写出反应方程式:2NH3(g)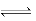 N2(g)+3H2(g),氨气的转化率为25%,则消耗氨气的物质的量为4×25%mol=1mol,消耗1mol氨气吸收46。1kJ的热量,消耗2mol时吸收2×46.1kJ=92.2kJ,因此热反应方程式为:2NH3(g)
N2(g)+3H2(g),氨气的转化率为25%,则消耗氨气的物质的量为4×25%mol=1mol,消耗1mol氨气吸收46。1kJ的热量,消耗2mol时吸收2×46.1kJ=92.2kJ,因此热反应方程式为:2NH3(g)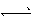 N2(g)+3H2(g) △H=+92.2kJ·mol-1;消耗1mol氨气的同时生成1.5molH2,v(H2)="1.5/(1×2)mol/(L·min)=0.75" mol/(L·min),也可采用速率之比等于系数之比,v(NH3)="1/(1×2)mol/(L·min)=0.5" mol/(L·min),v(H2)=3×v(NH3)/2=0.75mol/(L·min);(2)①达到平衡c(N2O4)=0.6mol·L-1,则c(NO2)=0.3mol·L-1,K=c(N2O4)/c2(NO2)=0.6/0.32=6.67;②a、ρ=m/v反应物和生成物都是气体,m不变,容器是恒容状态下,v不变,ρ不能作为达到平衡的标志,b、NO2红棕色气体、N2O4无色气体,颜色不再改变,能作为达到平衡的标志,c、反应前后气体系数之和不相等,压强可以作为达到平衡的标志,因此a选项是正确;③此时的浓度商Qc=c(N2O4)/c2(NO2)=6.67,此反应是放热反应升高温度化学平衡常数减小,Qc=K(298)>K(398),反应逆向移动,v正 < v逆;(3)根据原电池的工作原理,通入空气的一极为正极,则另一极为负极,NH3在负极上失电子,产生X气体可直接排放到大气中,说明X气体对环境无污染,即X:N2,从a极产生H2O,电解质溶液显碱性,2NH3+6OH--6e-=N2↑+6H2O;(3)NH3·H2O
N2(g)+3H2(g) △H=+92.2kJ·mol-1;消耗1mol氨气的同时生成1.5molH2,v(H2)="1.5/(1×2)mol/(L·min)=0.75" mol/(L·min),也可采用速率之比等于系数之比,v(NH3)="1/(1×2)mol/(L·min)=0.5" mol/(L·min),v(H2)=3×v(NH3)/2=0.75mol/(L·min);(2)①达到平衡c(N2O4)=0.6mol·L-1,则c(NO2)=0.3mol·L-1,K=c(N2O4)/c2(NO2)=0.6/0.32=6.67;②a、ρ=m/v反应物和生成物都是气体,m不变,容器是恒容状态下,v不变,ρ不能作为达到平衡的标志,b、NO2红棕色气体、N2O4无色气体,颜色不再改变,能作为达到平衡的标志,c、反应前后气体系数之和不相等,压强可以作为达到平衡的标志,因此a选项是正确;③此时的浓度商Qc=c(N2O4)/c2(NO2)=6.67,此反应是放热反应升高温度化学平衡常数减小,Qc=K(298)>K(398),反应逆向移动,v正 < v逆;(3)根据原电池的工作原理,通入空气的一极为正极,则另一极为负极,NH3在负极上失电子,产生X气体可直接排放到大气中,说明X气体对环境无污染,即X:N2,从a极产生H2O,电解质溶液显碱性,2NH3+6OH--6e-=N2↑+6H2O;(3)NH3·H2O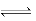 NH4++OH-,K1=c(OH-)×c(NH4+)/c(NH3·H2O) =1.8×10-5,NH4+的水解NH4++H2O
NH4++OH-,K1=c(OH-)×c(NH4+)/c(NH3·H2O) =1.8×10-5,NH4+的水解NH4++H2O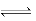 NH3·H2O+H+,K2=c(H+)×c (NH3·H2O)/c(NH4+),水的离子积Kw=c(H+)×c(OH-)=K1×K2=2.7×10-13,25℃时水的离子积是1×10-14<2.7×10-13,水的离子积随温度的升高而升高,即大于25℃。
NH3·H2O+H+,K2=c(H+)×c (NH3·H2O)/c(NH4+),水的离子积Kw=c(H+)×c(OH-)=K1×K2=2.7×10-13,25℃时水的离子积是1×10-14<2.7×10-13,水的离子积随温度的升高而升高,即大于25℃。
考点:考查热化学反应方程式的书写、化学反应速率的计算、平衡常数的计算、电极反应式的书写、离子积的计算等相关知识。
本题难度:困难
3、选择题 一定温度下,l mol X和nmol Y在体积为2L的密闭容器中发生如下反应:X(g)+ Y(g)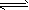 2Z(g)+M(s),5 min后达到平衡,此时生成2a mol Z。下列说法正确的是
2Z(g)+M(s),5 min后达到平衡,此时生成2a mol Z。下列说法正确的是
[? ]
A.用X表示此反应的反应速率是(0.1-0.2a) mol/(L·min)
B.当混合气体的质量不再发生变化时,说明反应达到平衡状态
C.向平衡后的体系中加入1 mol M,平衡向逆反应方向移动
D.向上述平衡体系中再充入1 mol X,v(正)增大,v(逆)减小,平衡正向移动
参考答案:B
本题解析:
本题难度:一般
4、选择题 在密闭容器中发生反应:aX(气)+bY(气)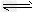 cZ(气)+dW(气)反应达到平衡后,保持温度不变,将气体压缩到原来的1/2体积,当再次达到平衡时,W的浓度为原平衡的1.8倍。下列叙述中不正确的是
cZ(气)+dW(气)反应达到平衡后,保持温度不变,将气体压缩到原来的1/2体积,当再次达到平衡时,W的浓度为原平衡的1.8倍。下列叙述中不正确的是
[? ]
A、平衡向逆反应方向移动?
B、a?+?b?>?c?+?d?
C、Z的体积分数减小?
D、X的转化率下降
参考答案:B
本题解析:
本题难度:一般
5、选择题 某温度下,在固定容积的密闭容器中,可逆反应A(g)+3B(g)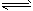 2C(g)达到平衡时,各物质的物质的量之比为n(A)∶n(B)∶n(C)=2∶2∶1。保持温度不变,以2∶2∶1的物质的量之比再充入A、B、C,则
2C(g)达到平衡时,各物质的物质的量之比为n(A)∶n(B)∶n(C)=2∶2∶1。保持温度不变,以2∶2∶1的物质的量之比再充入A、B、C,则
[? ]
A.平衡不移动
B.再达平衡时,n(A)∶n(B)∶n(C)仍为2∶2∶1
C.再达平衡时,C的体积分数增大
D.再达平衡时,正反应速率增大,逆反应速率减小
参考答案:C
本题解析:
本题难度:一般