微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 将过量的SO2分别通入下列溶液:①氢硫酸②溴水③品红溶液④澄清石灰水⑤酸性高锰酸钾⑥氯化钙溶液,根据要求填空。
(1)无明显现象的是?;
(2 )溶液颜色褪去的是?;
)溶液颜色褪去的是?;
(3)SO2作氧化剂的是?;
(4)SO2作还原剂的是?;
(5)先生成沉淀然后沉淀溶解的是?;
(6)有沉淀生成且沉淀不溶解的是?。
参考答案:( 1)⑥?(2)②③⑤?(3)①?(4)②⑤?(5)④?(6)①
1)⑥?(2)②③⑤?(3)①?(4)②⑤?(5)④?(6)①
本题解析:略
本题难度:简单
2、选择题 下列关于SO2的说法中,不正确的是
A.SO2是硫及某些含硫化合物在空气中燃烧的产物
B.SO2具有漂白性,可以使品红溶液褪色
C.SO2与水反应生成H2SO4
D.SO2既有氧化性又有还原性
参考答案:C
本题解析:二氧化硫作为大气污染气体,是硫及某些含硫化合物在空气中燃烧的产物,它的的性质包括:氧化性、还原性、漂白性及与水的反应:SO2与水反应生成H2SO3;故答案为C
本题难度:一般
3、实验题 现有如下仪器,仪器中已注入溶液,回答下列问题。

(1)加热装置A,写出铜与浓硫酸反应的化学方程式:?,烧瓶中的实验现象为?。
(2)验证碳、硅非金属性的相对强弱(已知酸性:H2SO3>H2CO3),若选择仪器A、B、C、D并相连接,则B、C、D中所选择的试剂分别为?、?、?。能说明碳的非金属性比硅强的实验现象是?。
(3)验证SO2的氧化性、还原性。若选择A、E、F仪器,并按A、E、F顺序连接。
①则证明SO2有氧化性的实验现象是?,反应方程式为:
?。
②若证明SO2具有还原性,在E中采取的实验操作为?,其实验现象为?,反应原理为?。
参考答案:(1)Cu+2H2SO4(浓)  ?CuSO4+SO2↑+2H2O;? 1分
?CuSO4+SO2↑+2H2O;? 1分
铜片变灰黑色表面有气泡生成,烧瓶中可能有白色物质生成 ?2分
(2)B:Na2CO3溶液或 NaHCO3 溶液?C:KMnO4溶液 D:Na2SiO3溶液 ;
C中KMnO4溶液不褪色(或品红不褪色),D中出现白色沉淀。?各1分,共4分
(3)①H2S溶液中有浅黄色混浊出现? 2H2S+SO2=3S↓+2H2O?各1分共2分
②通入氯气或加入氯水或加入过氧化氢溶液,或高锰酸钾溶液等氧化剂(其中一种或其它合理答案均可);现象是有白色沉定生成。?各1分共2分
根据所加入试剂写出方程式 Ba2++SO2+Cl2+2H2O=BaSO4↓+4H++2Cl? ?2分
本题解析:
△
?试题分析:(1)铜与浓硫酸反应的化学方程式Cu+2H2SO4(浓)  CuSO4+SO2↑+2H2O;烧瓶中的实验现象为铜片变灰黑色表面有气泡生成,烧瓶中可能有白色物质生成
CuSO4+SO2↑+2H2O;烧瓶中的实验现象为铜片变灰黑色表面有气泡生成,烧瓶中可能有白色物质生成
(2)因为酸性:H2SO3>H2CO3> H2SiO3,若选择仪器A、B、C、D,A中产生二氧化硫气体,需和碳酸盐反应产生二氧化碳气体,在通入硅酸钠溶液之前应把二氧化硫除去以免给实验带来干扰。所以B、C、D依次放Na2CO3溶液或 NaHCO3 溶液、KMnO4溶液(或品红溶液)、Na2SiO3溶液,能说明碳的非金属性比硅强的实验现象是C中KMnO4溶液不褪色(或品红不褪色),D中出现白色沉淀。
(3) ①则证明SO2有氧化性的实验是将二氧化硫气体通入硫化氢溶液中,有淡黄色浑浊产生,对应的化学方程式为2H2S+SO2=3S↓+2H2O,在该反应中二氧化硫作氧化剂,显示氧化性,
②若将二氧化硫直接通入氯化钡溶液中无现象,需将二氧化硫进一步氧化,氧化剂可选氯气、氯水、过氧化氢溶液、高锰酸钾溶液、铁盐溶液等,对应的现象是有白色沉淀产生,反应原理是:根据所加入试剂写出离子方程式 Ba2++SO2+Cl2+2H2O=BaSO4↓+4H++2Cl?
本题难度:一般
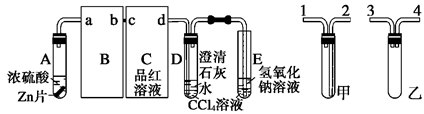
4、实验题 (14分)某校研究性学习小组,探究一定量的浓硫酸与足量锌充分反应产生的气体产物,进行如下实验:按图组装好实验装置,在A中加入5 mL 98%的浓硫酸和足量的锌粒,微热试管A,观察到C、D、E中均有气泡产生;随后气泡量减少,品红溶液褪色,D中先出现浑浊后浑浊消失;反应较长时间后,C、D、E中的气泡量又会明显增加。
试回答:
(1)写出A中从反应开始到停止可能发生反应的化学方程式:____________________________________。
(2)从甲、乙中选择合适的装置填入B、C中,并进行正确连接,a接____、____接b,c接____、____接d;D、E两支试管中CCl4溶液的作用是______________________________________________。
(3) ①能证明浓硫酸具有强氧化性的实验现象为____________________________________;
②反应较长时间后气泡量又会明显增加的原因是_______________________________________。
(4)D中浑浊消失的离子反应方程式为_________________________________________。
参考答案:(1)Zn+2H2SO4(浓)===ZnSO4+SO2↑+2H2O?Zn+H2SO4(稀)===ZnSO4+H2↑
(2)3或4 4或3 2 1 ?防倒吸
(3)C中品红溶液褪色 浓H2SO4变成稀H2SO4后,与Zn反应放出H2
(4)SO2+H2O+CaSO3===Ca2++2HSO
本题解析:(1)浓硫酸和锌反应生成硫酸锌、SO2和水。但随着反应的进行,硫酸的浓度逐渐降低,因此最后会生成氢气和硫酸锌,反应的方程式分别是Zn+2H2SO4(浓)===ZnSO4+SO2↑+2H2O、Zn+H2SO4(稀)===ZnSO4+H2↑。
(2)由于SO2极易溶于水,所以B处应该是防倒吸的装置,所以选择是乙装置;C处是检验SO2的漂白性的,所以选择甲装置,因此正确的连接顺序是3或4 4或3 2 1。由于SO2极易溶于水,而四氯化碳的密度不溶于水,且在水的下层,所以D、E两支试管中CCl4溶液的作用是防倒吸。
(3)①证明浓硫酸具有强氧化性,数目反应中有SO2生成,因此现象是C中品红溶液褪色。
②随着反应的进行,浓H2SO4变成稀H2SO4后,与Zn反应放出H2,所以气体又逐渐增加。
(4)由于过量的SO2能和亚硫酸钙反应生成亚硫酸氢钙,因此又变澄清,反应的方程式是SO2+H2O+CaSO3===Ca2++2HSO。
本题难度:一般
5、填空题 已知盐酸加到品红溶液中,使品红溶液的红色加深。试推测:
(1)向品红溶液中通过量SO2的过程中的现象为__________;加热后的现象为___________。
(2)向品红溶液中通入过量Cl2的过程中,观察到的现象为___________。
(3)向品红溶液中通入物质的量比为1∶1且足量的SO2和Cl2后现象为______________。
参考答案:(1)溶液颜色先变深后又逐渐褪去?逐渐恢复原来的红色
(2)溶液的颜色先变深后又逐渐褪去?不再恢复红色(或仍为无色)
(3)溶液的红色比原来加深
本题解析:当向品红溶液中通入过量的SO2时,发生如下反应:SO2+H2O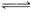 H2SO3,生成的酸能使品红溶液红色加深,因SO2过量,SO2与品红溶液结合成不稳定的无色物质而褪色,加热,无色物质分解又逐渐恢复到原来的红色。当向品红溶液中通入Cl2,因Cl2+H2O
H2SO3,生成的酸能使品红溶液红色加深,因SO2过量,SO2与品红溶液结合成不稳定的无色物质而褪色,加热,无色物质分解又逐渐恢复到原来的红色。当向品红溶液中通入Cl2,因Cl2+H2O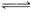 HClO+HCl,同样生成了酸,品红溶液红色加深,因Cl2过量,Cl2氧化有色物质而褪色,加热后不再恢复红色,当向品红溶液中通入1∶1的SO2和Cl2时,两者发生以下反应:Cl2+SO2+2H2O
HClO+HCl,同样生成了酸,品红溶液红色加深,因Cl2过量,Cl2氧化有色物质而褪色,加热后不再恢复红色,当向品红溶液中通入1∶1的SO2和Cl2时,两者发生以下反应:Cl2+SO2+2H2O 2HCl+H2SO4,因生成了酸,使品红溶液颜色加深。
2HCl+H2SO4,因生成了酸,使品红溶液颜色加深。
本题难度:简单