|
高考化学必考知识点《金属材料》高频考点特训(2017年练习版)(十)
2017-09-25 17:56:17
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 工业上利用硫酸渣(含Fe2+、Fe3+的硫酸盐及少量CaO和MgO)制备高档颜料铁红(Fe2O3 )和回收(NH4)2SO4,具体生产流程如下:
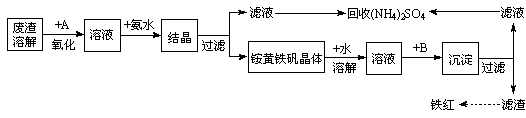
回答下列问题:
(1)在废渣溶解操作时,为了加速废渣溶解的措施是:___________________、__________________(任写两点)
(2)物质A是一种氧化剂
①工业上最好选用?(填序号)
A.空气
B.Cl2
C.MnO2
D.H2O2,
| ②简述工业上这样选择A的理由是?、________________(任意答2条)。
③写出A参与反应的离子方程式为__________________________________________
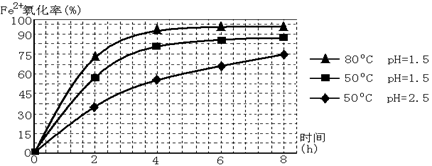
(3根据下图有关数据,你认为工业上氧化操作时应控制的条件是__________________。
(4)往铵黄铁矾溶液(含Fe3+)中加入溶液B至pH为5时产生沉淀,请写出产生沉淀的离子方程式:_______________________________________________________。
(5)写出铵黄铁矾晶体溶于适量蒸馏水中,往其中加入过量Ba(OH)2溶液,发生反应的离子方程式为:_____________________________________________________
(6)回收所得的(NH4)2SO4晶体可能含有的杂质是:___________________________
参考答案:(1)不断搅拌;将废渣粉碎;升高温度;适当增加A的浓度等 (2分)
(2)①A(空气)(2分)
②原料来源容易成本低;不产生污染;不引入杂质。(2分,答其中两点即可)
③4Fe2++O2+4H+=4Fe3++2H2O (2分)
(3)溶液温度控制在80℃,pH控制在1.5(1分),氧化时间为4小时左右(1分)
(4)Fe3++3NH3·H2O=Fe(OH)3↓+3NH4+(2分)
(5)NH4++Fe3+2SO42-+2Ba2++2OH-=2BaSO4↓+NH3.H2O+Fe(OH)3↓(2分)
(6)MgSO4、CaSO4(2分)
本题解析:(1)加快反应速率的因素有浓度、温度、增大接触面积等,因此加快溶解速率可以不断搅拌、将废渣粉碎、升高温度、适当增加A的浓度等 (2分)
(2)把Fe2+氧化为Fe3+,通入空气就行了,空气经济易得,可以节约成本,并且无污染。发生的离子反应方程式: 4Fe2++O2+4H+=4Fe3++2H2O (2分)
(3)曲线图中的因变量有温度、时间、pH值,因此对比分析溶液在80℃,pH控制在1.5,氧化时间为4小时左右时氧化效率最佳。
(4)根据流程可知,沉淀后得到的滤渣可以制备铁红,所以可知沉淀是Fe(OH)3 。滤液为(NH4)2SO4 ,则调节pH的试剂应该选用氨水,这样就不引入其他杂质离子,发生的反应为:Fe3++3 NH3·H2O=Fe(OH)3↓+3NH4+
(5)铵黄铁矾与氢氧化钡混合,NH4+与OH- 反应生成NH3.H2O, Fe3+与OH-生成Fe(OH)3 沉淀,SO42-与Ba2+生成BaSO4沉淀。所以离子方程式为NH4++Fe3+2SO42-+2Ba2++2OH-=2BaSO4↓+NH3.H2O+Fe(OH)3↓
(6)因为硫酸渣中含有CaO和MgO,加酸溶解以后在结晶得到铵黄铁矾时,分离得到的滤液没有除杂,因此会混有MgSO4、CaSO4 等杂质。 (2分)
本题难度:困难
2、选择题 在存放照相机、显微镜、食品和药品的包装盒中常发现一些袋装透明的胶状颗粒,该颗粒的主要作用是干燥,其成分是
A.活性炭
B.氯化钠
C.硅胶
D.小苏打
参考答案:C
本题解析:以上四种物质中只有硅胶是干燥剂。
本题难度:困难
3、选择题 下列说法正确的是(?)
A.自然界中所有金属都以化合态形式存在
B.化学史上,金、银、铜发现较早,钾、钠、铝发现较迟是因为前者自然界含量高,后者含量低
C.废旧金属处理的最好办法是深埋
D.冶炼金属的一般步骤是:浮选富集→冶炼→精炼
参考答案:D
本题解析:根据金属活动顺序表,极少数的不活泼金属在自然界可以以游离态存在,金属活动性差的可用热分解法或还原法,且冶炼容易,故A、B两项均不正确;各种废弃物处理常见方法是回收再利用,以便节省资源减少污染,C项不正确。
本题难度:一般
4、选择题 某孔雀石的主要成分为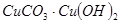 ,可用来冶炼铜。孔雀石与焦炭混合加热时,可生成铜、二氧化碳和水。下列说法不正确的是 ,可用来冶炼铜。孔雀石与焦炭混合加热时,可生成铜、二氧化碳和水。下列说法不正确的是
A.将孔雀石粉碎后与焦炭混合加热,是为了加快反应速率
B.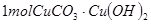 与足量焦炭反应转移2 与足量焦炭反应转移2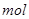 电子 电子
C.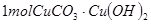 最多能与 最多能与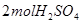 反应 反应
D.根据孔雀石样品的质量和其与足量硫酸反应产生 的体积(标准状况),即可测得样品中 的体积(标准状况),即可测得样品中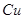 的质量分数(假定其他成分不与酸反应) 的质量分数(假定其他成分不与酸反应)
参考答案:B
本题解析: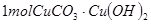 中含有2mol铜离子,应该转移2mol×2=4mol电子,选项B不正确,其余都是正确的,答案选B。 中含有2mol铜离子,应该转移2mol×2=4mol电子,选项B不正确,其余都是正确的,答案选B。
本题难度:简单
5、选择题 下列有关物质的用途(括号中为用途)错误的是
A.硅(半导体材料)
B.二氧化硅(制光导纤维)
C.水玻璃(用作粘合剂)
D.玻璃钢(用作耐火材料)
参考答案:D
本题解析:分析:A、根据硅的性质判断用途;
B、根据二氧化硅的用途判断;
C、根据水玻璃的性质判断用途;
D、根据玻璃钢的性质判断.
解答:A、硅在元素周期表中处于金属和非金属的过渡位置,硅的导电性介于导体和绝缘体之间,是良好的半导体材料,故A正确;
B、二氧化硅可用来制造光导纤维,故B正确;
C、水玻璃是一种粘性的物质,所以可用作粘合剂,故C正确;
D、玻璃钢学名玻璃纤维增强塑料,俗称FRP(Fiber Reinforced Plastics),即纤维增强复合塑料,不能耐高温,所以不能用作耐火材料,故D错误;
故选D.
点评:本题考查了物质的用途,难度不大,物质的性质决定用途,用途体现性质.
本题难度:一般
| 