| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高中化学必备知识点《氯及其化合物》试题巩固(2017年最新版)(八)
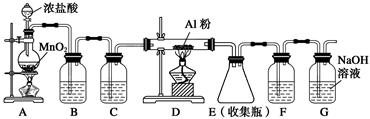 装置B中盛放饱和NaCl溶液,该装置的主要作用是______________。F中试剂的作用是____________________。用一件仪器装填适当试剂后可同时起到F和G的作用,所装填的试剂为________________。 参考答案:(1)B (2)除去氯气中HCl,降低氯气的溶解度 防止水蒸气进入E 碱石灰 本题解析:(1)NaClO属于盐,为强电解质,A项错误;向沸水中滴加饱和FeCl3溶液制备Fe(OH)3胶体,B项正确;HCl属于共价化合物,C项错误;电解NaCl溶液的阴极反应式为2H++2e-=H2↑,产生标准状况下22.4 L H2,理论上需要转移2NA个电子,D项错误。(2)浓盐酸易挥发导致氯气中含有HCl,装置B中饱和NaCl溶液能够除去HCl,降低氯气的溶解度。因AlCl3遇潮湿空气即产生大量白雾,故F装置盛放浓硫酸,防止水蒸气进入E装置。G在该实验中的作用是吸收未反应的氯气,故可以通过连接盛有碱石灰的干燥管同时起到两种作用。 本题难度:一般 4、选择题 用如图所示装置进行下列实验,放置一段时间后,实验结果与预测的现象不一致的是( )
A.A B.B C.C D.D |
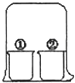
参考答案:A.浓盐酸和浓氨水都具有挥发性,挥发出的氯化氢和氨气相遇生成白烟氯化铵,所以装置内出现白烟,故A正确;
B.浓硝酸具有挥发性,硝酸溶于水得稀硝酸溶液,酚酞遇稀硝酸不变红,故B错误;
C.饱和氯水挥发出氯气,氯气能和碘化钾反应生成碘,碘遇淀粉变蓝色,所以①中溶液变蓝,故C正确;
D.浓硫酸具有吸水性,能吸收饱和硫酸铜溶液中的水分,导致硫酸铜溶液过饱和而析出五水硫酸铜晶体,故D正确;
故选B.
本题解析:
本题难度:简单
5、填空题 (15分)回答下列问题。
(1) 漂白粉与浓盐酸相遇时有黄绿色气体生成,若产生气体在标准状况下的体积为11.2L,则有?molHCl被氧化。
(2) 向氯水中加入CaCO3固体后,氯水的杀菌、漂白能力将?(填增强或减弱)其原因是?。
(3)二氧化硫气体与含1.5 mol Cl元素的一种含氧酸(该酸的某盐常用于实验室制取氧气)的溶液在一定条件下反应,可生成一种强酸和一种气态氯氧化物A,若有1.5×6.02×1023个电子转移时,该反应的化学方程式是: ? ?。
(4)我国卫生部已明确提出:要逐步用氯的氧化物A替代氯气进行饮用水的消毒。
①氯的氧化物A不稳定,可与NaOH溶液、H2O2反应,Cl元素转化为比较稳定的正三价物质,该反应的化学方程式为?。
② 用氯的氧化物A处理过的自来水中会残留少量A,可用FeCl2将其还原为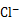 。现用VL(已换算为标准状况) A处理一定量自来水,再加入a mol FeCl2可将残留的A恰好除去,则该自来水中残留A的物质的量为?。
。现用VL(已换算为标准状况) A处理一定量自来水,再加入a mol FeCl2可将残留的A恰好除去,则该自来水中残留A的物质的量为?。
参考答案:(15分)
(1)0.5?2分?(2) 增强? 1分?Cl2+H2O H++ Cl-+ HClO?,
H++ Cl-+ HClO?,
CaCO3固体与H+反应,降低H+的浓度,使平衡向右移动,HClO的浓度增大。? 3分
(3) ?SO2+2HClO3=H2SO4+2ClO2? 3分
(4) ?①2ClO2+2 NaOH+H2O2=2 NaClO2+2H2O+O2? 3分?②a/5 mol 3分
本题解析:略
本题难度:一般
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高考化学必考知识点《金属材料》.. | |