微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 在2L密闭容器中,加入X和Y各4mol,一定条件下发生化学反应:2X(g)+ 2Y(g) Z(g)+2 W(g)△H<0,反应进行到5s时测得X的转化率为25%,10 s后达到化学平衡,测得Z的浓度为0.5mol/L,则下列说法正确的是
Z(g)+2 W(g)△H<0,反应进行到5s时测得X的转化率为25%,10 s后达到化学平衡,测得Z的浓度为0.5mol/L,则下列说法正确的是
A.5s内平均反应速率为υ(Y)=" 0.2" mol/( L·s)
B.该反应的平衡常数数值为0.5
C.保持容积体积不变,向容器中通入惰性气体可提高反应物的转化率
D.升高温度,当测得容器中密度不变时,表示该反应已经达到平衡状态
参考答案:B
本题解析:略
本题难度:一般
2、选择题 下列有关化学方应方向的说法中正确的是
A.凡是焓变小于零的反应都能自发进行
B.凡是熵变小于零的化学反应都能自发进行
C.凡是焓变小于零,熵变大于零的化学变化都能自发进行
D.CaCO3在高温下的分解反应不属于自发过程
参考答案:C
本题解析:考查反应的自发性和化学反应进行的方向。一般情况下放热反应容易自发,熵值增加的反应容易自发,但不是绝对的。根据△G=△H-T·△S可知,当△H<0、△S>0时反应一定是自发的。答案是C。
本题难度:简单
3、选择题 完全相同的两个容器甲和乙,已知甲中装有SO2、O2各1克,乙中装有SO2 O2各2克,在同一温度下反应,2SO2(g)+O2(g)? 2SO3(g)达平衡时,甲中SO2的转化率为a% ,乙中SO2的转化率为b%,则?(?)

A.a% > b%
B.a%< b%
C.a%=" b%"
D.无法判定
参考答案:B
本题解析:建立这样的模型,把乙中的SO2、O2平均分成2份,每份为1克 SO2和 O2,然后,在与甲相同的容器中建立两个完全相同的平衡状态。如:
1g SO2
1g O2
1g SO2
1g O2

2g SO2
2g O2
本题难度:一般
4、填空题 某兴趣小组探究以芒硝Na2SO4·10H2O和CaO为原料制备Na2CO3。
(1)将CaO水化后,与芒硝形成Na2SO4-Ca(OH)2-H2O三元体系,反应后过滤,向滤液中通入CO2,期望得到Na2CO3。三元体系中反应的离子方程式为: SO42-+ Ca(OH)2(s)+2H2O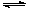 CaSO4·2H2O(s)+2 OH-
CaSO4·2H2O(s)+2 OH-
该反应的平衡常数表达式K=_________________________。
往Na2SO4-Ca(OH)2-H2O三元体系中添加适量的某种酸性物质,控制pH="12.3" [即c(OH-)=0.02mol/L],可使反应在常温下容易进行。反应后过滤,再向滤液中通入CO2,进一步处理得到Na2CO3。
(2)在Na2SO4-Ca(OH)2-H2O三元体系中不直接通入CO2,其理由是_______________________________________________________________。
(3)添加的酸性物质须满足的条件(写出两点)是_____________、______________。
(4)用平衡移动原理解释添加酸性物质的理由:____________________________________;以HA表示所添加的物质,则总反应的离子方程式可写为_______________________。
(5)Na2CO3溶液中存在水解平衡:CO32-+H2O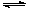 HCO3-+OH-。下列说法错误的是_________。
HCO3-+OH-。下列说法错误的是_________。
a.加水稀释,溶液中所有离子的浓度都减小
b.通入CO2,溶液pH减小
c.加入NaOH固体, 减小
减小
d.稀释溶液,平衡常数增大
参考答案:(1)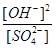
(2)碱性条件下CO2与Ca2+生成难溶物CaCO3
(3)不与Ca2+生成难溶物?酸性比碳酸弱
(4)酸性物质与OH-反应,使平衡向生成CaSO4·2H2O的方向进行? SO42-+ Ca(OH)2+2HA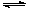 CaSO4·2H2O↓+2A- (每空2分)
CaSO4·2H2O↓+2A- (每空2分)
(5)(2分)a d
本题解析:(1)根据平衡常数表达式,该反应的平衡常数表达式K=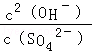 ;
;
(2)①在碱性条件下CO2与Ca2+生成难溶物CaCO3,所以不直接通入CO2;
(3)加入酸性物质,氢离子可以中和氢氧根离子,使平衡向着生成CaSO4?2H2O的方向进行;以HA表示所添加的酸性物质,由于HA酸性要小于碳酸酸性,反正方程式中应该写成分子式,所以总反应的离子方程式为SO42﹣+Ca(OH)2+2HA?CaSO4?2H2O↓+2A﹣;
(5)a.加水稀释,平衡右移溶液中CO32-,HCO3-,OH-离子的浓度都减小,但氢离子浓度增大,错误;b.通入CO2,溶液酸性增加,pH减小,正确;c.加入NaOH固体,平衡左移, 减小,正确;d.稀释溶液,平衡常数不变,错误;
减小,正确;d.稀释溶液,平衡常数不变,错误;
本题难度:一般
5、选择题 反应2SO2+O2==2SO3,经一段时间后,SO3的浓度增加了0.4mol·L-1,在这段时间内用O2表示的反应速率为0.04mol·L-1·s-1,则这段时间为
[? ]
A.0.1s
B.2.5s
C.5s
D.10s
参考答案:C
本题解析:
本题难度:简单