|
高考化学知识点总结《无机非金属材料》在线测试(2017年最新版)(四)
2017-09-25 18:00:17
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (13分)海藻中提取碘的流程如图:
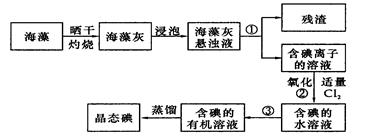
(1)指出提取碘的过程中有关实验操作名称:①__________,③________;写出过程②中有关反应的离子方程式_____________________________
(2)在提取碘的过程中,可供选择的有机试剂有下列四组,均可使用的是______ 。
A.苯、酒精
B.四氯化碳、苯
C.汽油、醋酸
D.汽油、氨水
| (3)在3mL碘水中,加入1mL四氯化碳,振荡、静置后,观察到试管里的分层现象是
?(注:下图片中深色区为紫红色溶液)
 ? ?
(4)为使海藻灰中碘离子转化为碘的有机溶液,实验室里有烧杯、玻璃棒、集气瓶、酒精灯、导管、圆底烧瓶、石棉网以及必要的夹持器、物品,尚缺少的玻璃仪器是_____________。
(5)从含碘的有机溶液中提取碘和回收有机溶剂,还需经过蒸馏,指出上图实验装置中的错误之处。
①____________ ;②_____________;③____________________。
参考答案:(10分)(1) ①过滤,③萃取分液;Cl2+ 2I- ="=" 2Cl-+ I2
(2)B。?(3) ( D?)? (4)普通漏斗?分液漏斗 (各1分,共2分)
(5) ①温度计不能插入溶液中,应放在支管口;
②冷凝管中水流方向相反了;?③没有石棉网
本题解析:略
本题难度:一般
2、填空题 (12分)工业上,以钛铁矿为原料制备二氧化钛的工艺流程如下图所示。钛铁矿主要成分为钛酸亚铁(FeTiO3),其中一部分铁元素在风化过程中会转化为+3价。
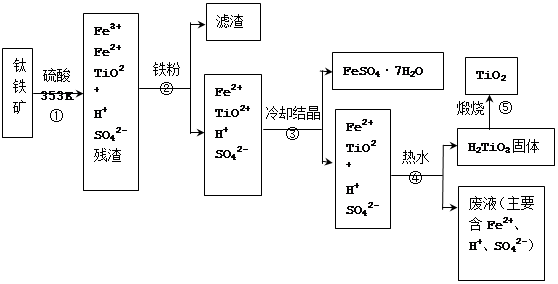
已知:TiOSO4遇水会水解。
(1)步骤②中,用铁粉将Fe3+转化为Fe2+的反应的离子方程式为?。
(2)步骤③中,实现混合物的分离是利用物质的?(填字母序号)。a. 熔沸点差异 b. 溶解性差异? c. 氧化性、还原性差异
(3)步骤②、③、④中,均需用到操作是?(填操作名称)。
(4)可以利用生产过程中的废液与软锰矿(主要成分为MnO2)反应生产硫酸锰(MnSO4,易溶于水),则反应的离子方程式为?。
(5)研究发现,可以用石墨作阳极、钛网作阴极、熔融CaF2-CaO作电解质,利用下图所示装置获得金属钙,并以钙为还原剂,还原二氧化钛制备金属钛。
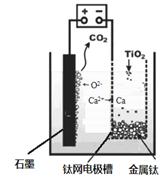
①写出阳极所发生反应的电极反应式:?。
②在制备金属钛前后,CaO的总量不变,其原因是
(请结合化学用语解释)?
参考答案:(1)2Fe3+ + Fe =3Fe2+?(2分)(2)b? (1分)(3)过滤(1分)
(4)MnO2 + 2Fe2+ + 4H+ = Mn2+ + 2Fe3+ + 2H2O(2分)
(5)① 2O2- - 4e- = O2↑或 C + 2O2- - 4e- = CO2↑(2分)
②制备TiO2时,在电解槽发生如下反应:2CaO 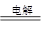 2Ca + O2↑,? 2Ca + TiO2 ="Ti" + 2CaO,由此可见,CaO的量不变。或:?制备TiO2时,在电解槽发生如下反应: 2Ca + O2↑,? 2Ca + TiO2 ="Ti" + 2CaO,由此可见,CaO的量不变。或:?制备TiO2时,在电解槽发生如下反应:
阴极:2Ca2+ + 4e- = 2Ca?
阳极:2O2- - 4e- = O2↑
2Ca + TiO2 =" Ti" + 2CaO,由此可见,CaO的量不变。(2分)
本题解析:(1)铁离子能把铁单质氧化生成亚铁离子,方程式为2Fe3+ + Fe =3Fe2+?。
(2)冷却结晶,有固体析出,因此是利用了物质溶解性的差异,答案选b。
(3)根据流程图可知,三次实验中均产生不溶性物质,所以都需要过滤。
(4)二氧化锰具有氧化性,能氧化废液中的亚铁离子,方程式为MnO2 + 2Fe2+ + 4H+ = Mn2+ + 2Fe3+ + 2H2O。
(5)①电解池中阳极失去电子,所以根据熔融体中的离子可知,应该是氧离子失去电子,即 2O2- - 4e- = O2↑或 C + 2O2- - 4e- = CO2↑。
②由于制备TiO2时,在电解槽发生如下反应:2CaO  2Ca + O2↑,? 2Ca + TiO2 ="Ti" + 2CaO,所以CaO的量不变。 2Ca + O2↑,? 2Ca + TiO2 ="Ti" + 2CaO,所以CaO的量不变。
本题难度:一般
3、选择题 从海水中提取镁最基本的方法是往海水中加碱,得到Mg(OH)2沉淀,将沉淀分离出来后再加入盐酸把它变成MgCl2;再经过滤、干燥、电解即可得到金属镁。下列对从海水中提取镁的有关说法中,正确的是( )
A.整个过程中没有涉及置换反应
B.往海水里加碱是指直接加入NaOH
C.电解MgCl2溶液即可得到金属镁
D.电解时得到的镁蒸气应在CO2氛围中冷却
参考答案:A
本题解析:从海水中提取镁发生的反应有:MgCl2+Ca(OH)2====Mg(OH)2↓+CaCl2,Mg(OH)2+2HCl====MgCl2+2H2O,MgCl2 Mg+Cl2↑。 Mg+Cl2↑。
最后一步是电解熔融的氯化镁,而不是电解MgCl2溶液。得到的镁蒸气应在H2或Ne中冷却,不能用N2、CO2,因Mg与N2、CO2反应。
本题难度:简单
4、选择题 若实行海水淡化供应饮用水,下列方法在原理上完全不可行的是(? )
A.用明矾使海水中的盐分沉淀而淡化
B.利用太阳能使海水蒸馏而淡化
C.将海水缓慢凝固以获取淡化的饮用水
D.将海水通过离子交换树脂,以除去所含盐分的离子
参考答案:A
本题解析:海水淡化的方法:蒸馏法、电渗析法、离子交换法。选项A,加明矾,明矾的主要成分是KAl(SO4)2·12H2O,生成Al(OH)3胶体吸附海水中的悬浮物,但不能使海水中的盐沉淀出来,所以不能使海水淡化。
本题难度:一般
5、选择题 工业上制石英玻璃和光导纤维的重要原料是
A.Al2O3
B.MgO
C.SiO2
D.Si
参考答案:C
本题解析:制石英玻璃和光导纤维的重要原料是SiO2,故选C。
本题难度:困难
|  ?
?