微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 化学中常用图像直观地描述化学反应的进程或结果。下列图像描述正确的是
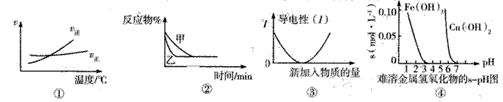
[? ]
A.图①可表示可逆反应A2(g)+3B2(g) 2AB3(g) △H>0的正逆反应速率随温度的变化
2AB3(g) △H>0的正逆反应速率随温度的变化
B.图②表示压强对可逆反应2A(g)+2B(g) 3C(g)+D(s)的影响,乙的压强大
3C(g)+D(s)的影响,乙的压强大
C.图③可表示乙酸溶液中通入氨气至过量过程中溶液导电性的变化
D.根据图④,若要除去CuSO4溶液中的Fe3+,可向溶液中加入适量CuO至pH在4左右
参考答案:D
本题解析:
本题难度:一般
2、选择题 某探究小组利用丙酮的溴代反应(CH3COCH3+Br2 CH3COCH2Br+HBr)来研究反应物浓度与反应速率的关系。反应速率v (Br2)通过测定溴的颜色消失所需的时间来确定。在一定温度下,获得如下实验数据:
CH3COCH2Br+HBr)来研究反应物浓度与反应速率的关系。反应速率v (Br2)通过测定溴的颜色消失所需的时间来确定。在一定温度下,获得如下实验数据:
实验
序号
| 初始浓度 c/mol·L-1
| 溴颜色消失
所需时间 t/s
|
CH3COCH3
| HCl
| Br2
|
①
| 0.80
| 0.20
| 0.0010
| 290
|
②
| 1.60
| 0.20
| 0.0010
| 145
|
③
| 0.80
| 0.40
| 0.0010
| 145
|
④
| 0.80
| 0.20
| 0.0020
| 580
|

 分析实验数据所得出的结论不正确的是
分析实验数据所得出的结论不正确的是
 A. v (Br2)与c(CH3COCH3)成正比
A. v (Br2)与c(CH3COCH3)成正比
B.增大c(Br2),v (Br2)变小
 C.增大c(HCl),v (Br2)增大
C.增大c(HCl),v (Br2)增大
D.实验②和③的v (Br2)相等
参考答案:B
本题解析:由①、②可知c(CH3COCH3)增大,v (Br2)增大,故A项说法正确;由①、④可知增大c(Br2),v (Br2)不变,故B项说法错误;由①、③可知增大c(HCl),v (Br2)增大,故C项说法正确;由②、③可知所用时间相同,速率相同,故D项说法正确;本题选B。
考点:化学反应速率与浓度关系。
本题难度:困难
3、选择题 以下反应均在密闭容器中进行,根据相应的图象,下列相关说法正确的是( )
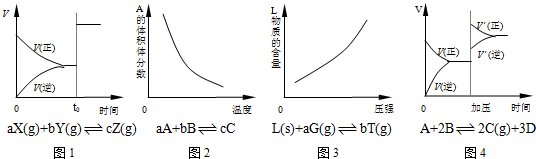
A.图1所示为t0时改变某一条件时速率变化,则改变的条件一定是加入催化剂
B.图2所示为反应达到平衡时温度对化学平衡的影响,则正反应为放热反应
C.图3所示为反应达到平衡时压强对化学平衡的影响,则反应方程式中a<b
D.图4所示为平衡后加压时反应速率的变化,则A、B是气体、D为固体或液体
参考答案:A.图1在t0时正逆反应速率都增大,平衡不移动,不一定是催化剂的原因,如a+b=c,增大压强,反应速率增大,平衡不移动,故A错误;
B.图2A的体积分数随温度的升高而降低,说明温度升高,平衡向正反应方向移动,则正反应为吸热反应,故B错误;
C.图3L物质的含量随压强的增大而增大,说明增大压强平衡向逆反应方向移动,则反应方程式中a<b,故C正确;
D.图4增大压强,平衡向正反应方向移动,说明气体反应物的化学计量数之和大于其它气体生成物的化学计量数之和,则则A、B是气体、D为固体或液体,故D正确.
故选CD.
本题解析:
本题难度:简单
4、选择题 可逆反应mA(g)+n(B) pC(g)+qD(g),A和C都是无色气体,达到平衡后,下列有关说法正确的是(?)
pC(g)+qD(g),A和C都是无色气体,达到平衡后,下列有关说法正确的是(?)
A.若增加B的量,平衡体系颜色加深,说明B是气体
B.增大压强,平衡不移动,说明m+n一定等于p+q
C.升高温度,A的转化率减小,说明正反应是吸热反应
D.若D是气体,增大A的量,A和B的转化率并不都增大
参考答案:D
本题解析:气体的颜色可能是B或D的颜色。如果是D的颜色,B可能是固体,B和D可能有一种或两种是固体。在有两种以上的反应物的可逆反应中,被增加的反应物转化率减小,另一种转化率增大。
本题难度:简单
5、填空题 (14分)Ⅰ.在用稀硫酸与锌制取氢气的实验中,加入少量硫酸铜溶液可加快氢气的生成速率。请回答下列问题:
(1)加入少量硫酸铜溶液可以加快氢气生成速率的原因是?;
(2)要加快上述实验中气体产生的速率,还可采取的措施有?(答两种);
(3)为了进一步研究硫酸铜的量对氢气生成速率的影响,某学习小组设计了如下一系列实验。将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需时间。
?实验
混合溶液
| A
| B
| C
| D
| E
| F
|
4 mol·L-1H2SO4?/ mL
| 30
| V1
| V2
| V3
| V4
| V5
|
?饱和CuSO4溶液 / mL
| 0
| 0.5
| 2.5
| 5
| V6
| 20
|
H2O / mL
| V7
| V8
| V9
| 15
| 10
| 0
|
?请完成此实验设计,其中:V2 ?V5 =?, V6=?,V8=?;
(第一空填“>”、“<”或“=”;后三空填具体数值)
Ⅱ.常温下,某一元酸HA和NaOH溶液等体积混合,HA和NaOH的浓度以及混合后溶液的pH如下表:
组别
| c(HA)/mo1·L-1
| c(NaOH)/mo1·L-1
| 混合液pH
|
甲
| c
| 0.2
| pH = 7
|
乙
| 0.2
| 0.1
| pH>7
|
丙
| 0.1
| 0.1
| pH = 9
|
请回答下列问题:
(4)仅从甲组情况分析,c是否一定等于0.2 ??(选填“是”或“否”)。
(5)分析乙组实验数据,HA是?酸(选填“强”或“弱”)。该混合液中离子浓度由大到小的顺序是?。
(6)丙组所得混合液中由水电离出的c(OH-) =?mo1·L-1。
参考答案:(14分)
 Ⅱ.(4)否(1分);
Ⅱ.(4)否(1分);
(5)弱(1分);c(Na+)>c(A-)>c(OH-)>c(H+)(或 [Na+]>[A-]>[OH-]>[H+])(2分)
(6)10-5?(2分);
本题解析:(1)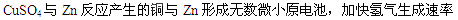
(2)加快化学反应的速率的因素有:升高温度、加入催化剂、增大压强(有气体参加的反应)、增大反应物的浓度、反应物的接触面积大小等,本题可采用的措施有:
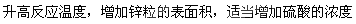
(3)该实验的目的为:研究硫酸铜的量对氢气生成速率的影响,所以所取硫酸的量就是相同的,即V2=V5 =30;
由所加饱和CuSO4溶液的数据分析可得:V6=10;比较D、E、F中饱和CuSO4溶液的体积与所加水的体积分析可知,饱和CuSO4溶液的体积与加入水的体积和为20,进而求得V8=19.5;
(4)对于甲组来说,溶液的pH = 7为中性溶液,但无法确定c是否一定等于0.2,HA可以为弱酸,也可以为强酸;
(5)由乙组数pH>7,溶液呈碱性,且在等体积混合的情况下,HA的浓度又是NaOH溶液的2倍,即可得HA一定为弱酸。该混合体系中,溶液中的溶质为等物质的量的HA、NaA,
溶液中的离子成分为:Na+、A-、H+、OH-四种成分,由于溶液呈碱性,即以A-水解为主HA电离为次,所以溶液中各离子浓度的大小关系为:c(Na+)>c(A-)>c(OH-)>c(H+)
(6)丙组为等体积等物质的量浓度的一元酸与一元碱混合,混合后溶液中的溶质为NaA,因溶液的pH = 9,即HA为弱酸,A-水解使溶液呈碱性,促进水的电离。水电离出的c(OH-) =10-5
本题难度:简单