微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 一定温度下,对于反应N2+O2 2NO在密闭容器中进行,下列措施能加快反应速率的是( )
2NO在密闭容器中进行,下列措施能加快反应速率的是( )
A.增大体积使压强缩小
B.恒容,充入N2
C.恒容,充入He气
D.恒压,充入He气
参考答案:B
本题解析:增大体积使压强缩小,反应速率降低。恒容,充入N2,氮气浓度增大,反应速率加快。恒容,充入He气,则浓度不变,反应速率不变。恒压,充入He气,容器体积增大,反应速率降低,答案选B。
点评:该题是高考中的常见题型,属于基础性试题的考查。试题基础性强,侧重对学生基础知识的巩固与训练,有助于培养学生的逻辑推理能力和抽象思维能力。该题的关键是明确压强对反应速率的影响是通过改变浓度实现,且只能适用于气体体系。
本题难度:一般
2、选择题 100mL浓度为2mol·L-1的盐酸跟过量的锌片反应,为加快反应速率,又不影响生成氢气总量,可采用的方法是
[? ]
A.加入少量浓盐酸
B.加入几滴氯化铜溶液
C.加入适量蒸馏水
D.加入适量的氯化钠溶液
参考答案:B
本题解析:
本题难度:一般
3、选择题 下列有关化学反应速率的说法正确的是
[? ]
A.用铁片和稀硫酸反应制取氢气时,改用98%的浓硫酸可以加快产生氢气的速率
B.100ml 2mol/L的盐酸跟锌片反应时,加入适量的氯化钠溶液,反应速率加快
C.SO2的催化氧化是一个放热反应,所以升高温度,反应速率减慢
D.汽车尾气中的NO和CO反应转化为无害的N2和CO2,减小压强,反应速率减慢
参考答案:D
本题解析:
本题难度:一般
4、简答题 某研究小组为比较Al和Fe的金属性强弱,设计了图1所示的装置,甲中锥形瓶内盛放的是100ml稀盐酸(反应前后溶液体积变化可以忽略不计).
(1)若要比较产生气体的快慢有两种方法,一种是比较产生相同体积气体所需的时间,另一种是比较______.
(2)为了确保“Al和Fe的金属活动性不同是导致产生气体速率不同的唯一原因”,实验时需要控制好反应条件.实验时除需保证甲中液体的体积、物质的量浓度和温度相同外,还需保证______.
(3)实验测得产生气体的速率(v)与时间(t)的关系如图2所示,则t1~t2时间内速率逐渐加快说明该反应是______(填放热或吸热)反应,t2~t3时间内速率逐渐减慢的主要原因是______.
(4)能使甲中的反应停止的操作是______.
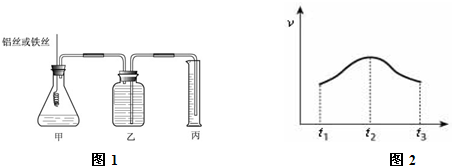
参考答案:(1)由v=△V△t知,反应速率与气体的体积和时间有关,所以一种是固定体积比较时间,另一种是固定时间比较体积.
故答案为:相同时间内产生气体体积大小;
(2)影响化学反应速率的因素有反应物的浓度、溶液的温度、固体的表面积等,所以还需保证Al和Fe表面积相同.
故答案为:Al和Fe表面积相同;
(3)该反应是一个放热的反应,随着反应的进行,放出的热量越多,溶液的温度越高,温度越高反应速率越大;随着反应的进行,溶液中盐酸的浓度不断减小,浓度越小反应速率越小.
故答案为:放热;盐酸浓度不断减小;
(4)要想使反应停止,没有反应物即可,所以将铁丝或铝丝从溶液中拔出即可停止反应.
故答案为:铁丝或铝丝从溶液中拔出.
本题解析:
本题难度:一般
5、选择题 称取三份锌粉,分别盛于甲、乙、丙三支试管中?。甲加入50mLpH=3的盐酸,乙加入50mLpH=3的醋酸,丙加入50mLpH=3的醋酸及少量的胆矾粉末。若反应终了,生成氢气的体积一样多,且没有剩余的锌,则下列说法错误的是
[? ]
A.开始时反应速率的大小:甲=乙=丙?
B.反应过程中,甲、乙速率相同
C.反应终了时,所需时间的大小:甲>乙>丙
D.三支试管中参加反应的锌的质量:甲=乙<丙?
参考答案:B
本题解析:
本题难度:一般